A2 – Textilfärbung
Bei der Herstellung von gefärbten Textilien entstehen erhebliche Mengen an Abwasser. Diese können bei nicht fachgerechter Entsorgung zu Umwelt- und Gesundheitsschäden führen.
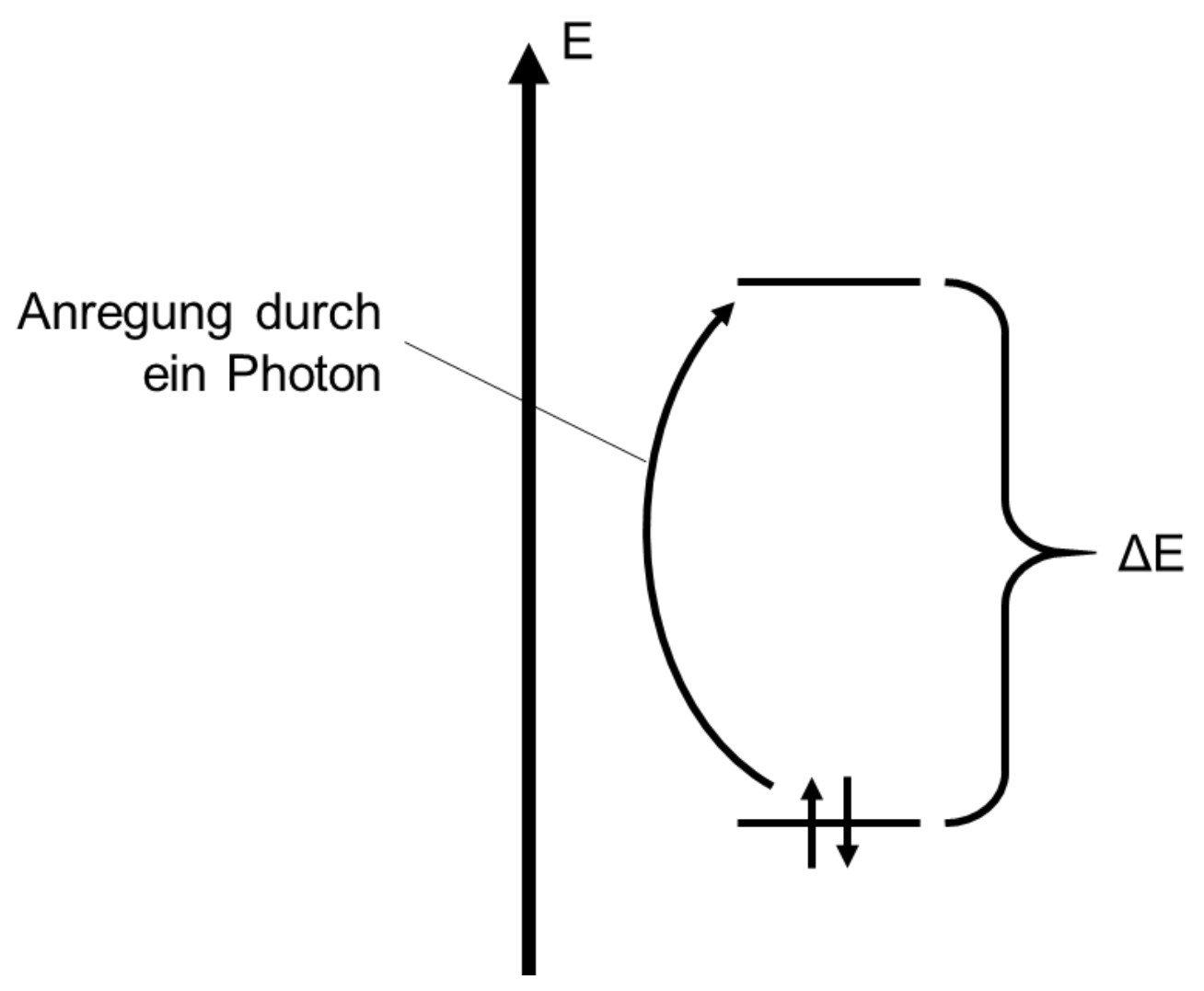
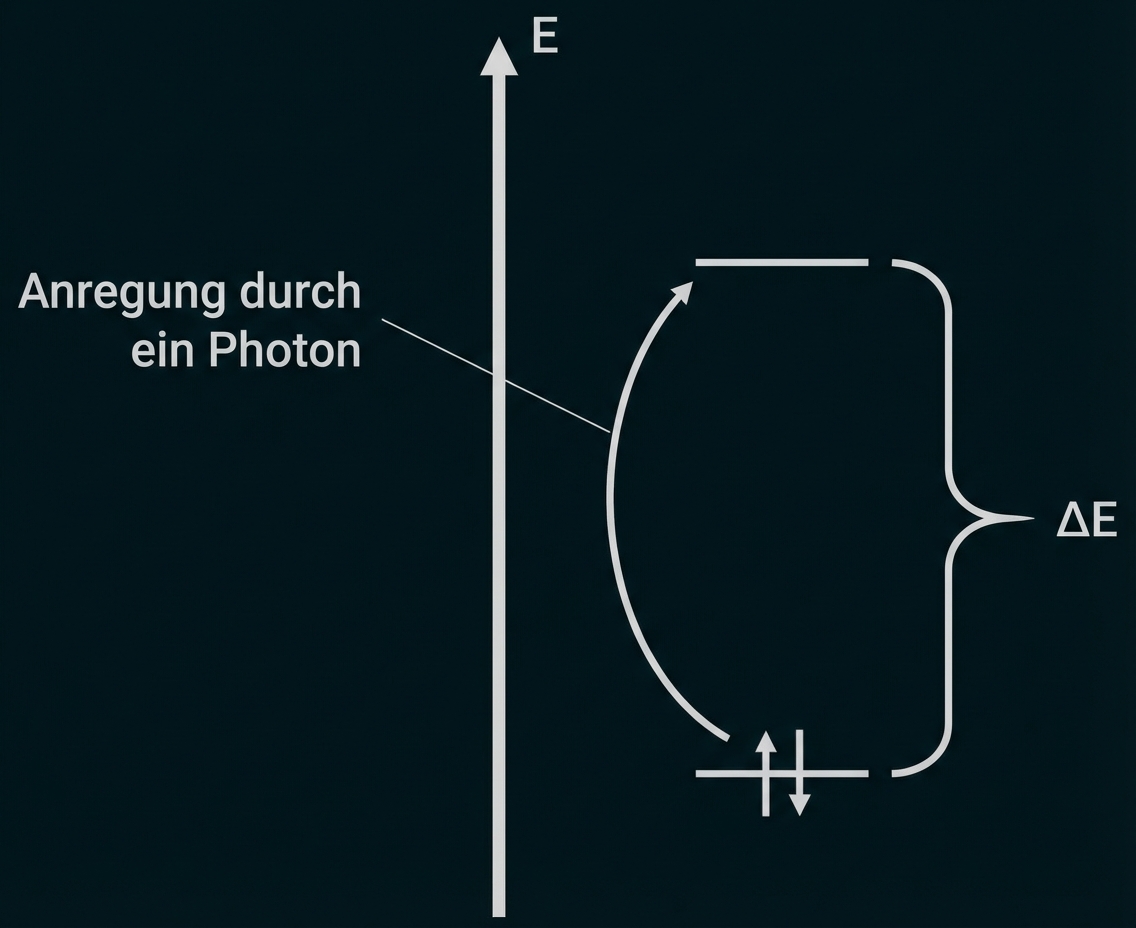
Erkläre unter Verwendung eines Energiestufenschemas die Ursache für die Farbigkeit von Stoffen. Beschreibe das dargestellte Absorptionsspektrum (Abb. 3) und leite daraus die Farben von Indigo und Leukoindigo ab. (M 1)
Begründe, dass es sich bei der Reaktion von Indigo zu Leukoindigo um eine Redoxreaktion handelt. Erkläre anhand der Löslichkeiten von Indigo und Leukoindigo das Vorgehen beim Färben. (M 1)
Leite den Reaktionstyp sowie die notwendigen Monomere zur Synthese des angegebenen Aramids (Abb. 6) ab. Begründe anhand des Struktur-Eigenschafts-Prinzips die thermischen Eigenschaften der beiden Kunststoffe. (M 2)
Plane ein Experiment, mit dem du die Hypothese zur Adsorption von Säurerot 73 überprüfen kannst, und begründe deine Vorgehensweise. (M 2)
Bewerte die beiden Verfahren zur Entfernung von Säurerot aus Färbereiabwässern unter dem Aspekt der Nachhaltigkeit. (M 2)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?Material 1: Indigo
Indigo ist eines der ältesten bekannten Pigmente und wird häufig zum Färben von Jeans verwendet. Um den Feststoff Indigo auf die Kleidungsstücke aufzubringen, wird wie folgt vorgegangen: In basischer wässriger Lösung reagieren Indigo-Moleküle (Abb. 1) mit Dithionit-Ionen Dabei bildet sich Leukoindigo (Abb. 2) und Schwefeldioxid. In die Leukoindigo enthaltende Lösung wird die Jeans getaucht. Beim anschließenden Trocknen an der Luft reagiert das Leukoindigo mit Sauerstoff zu Indigo zurück.
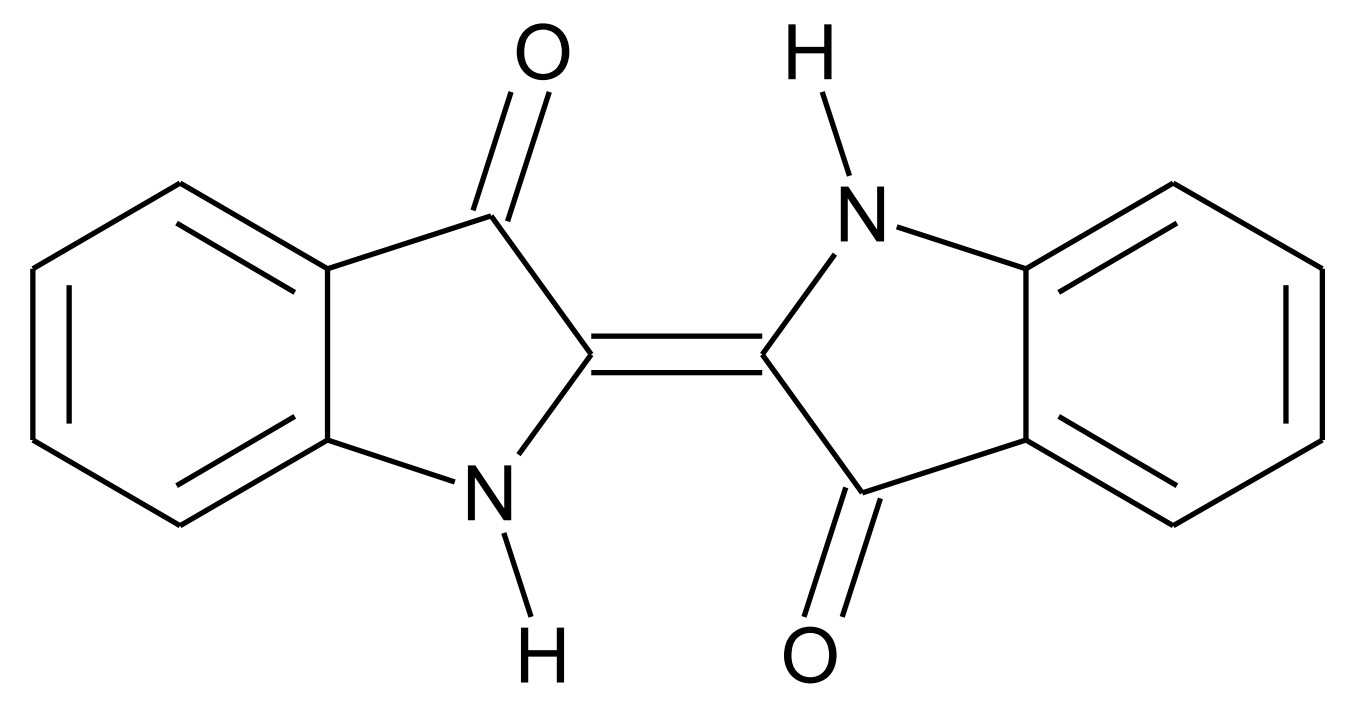
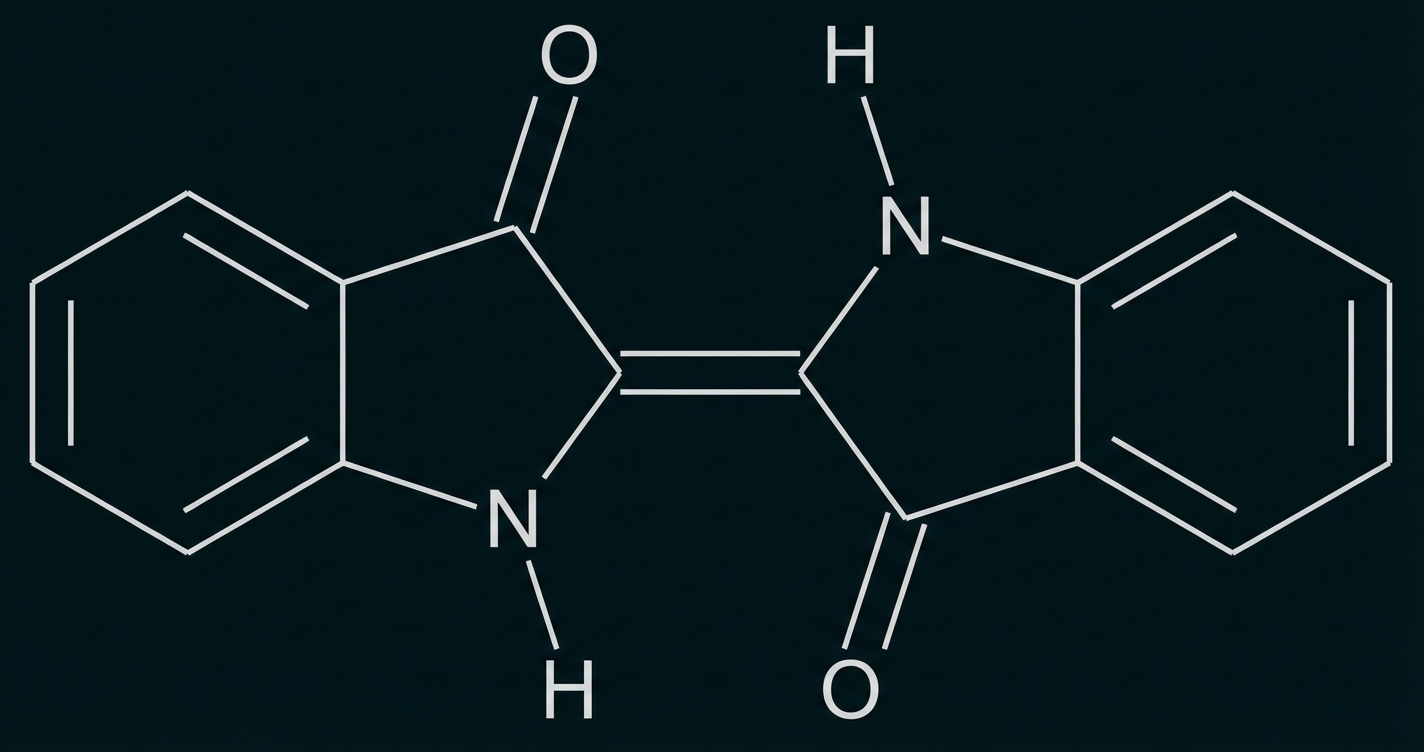
Abb. 1: Strukturformel von Indigo
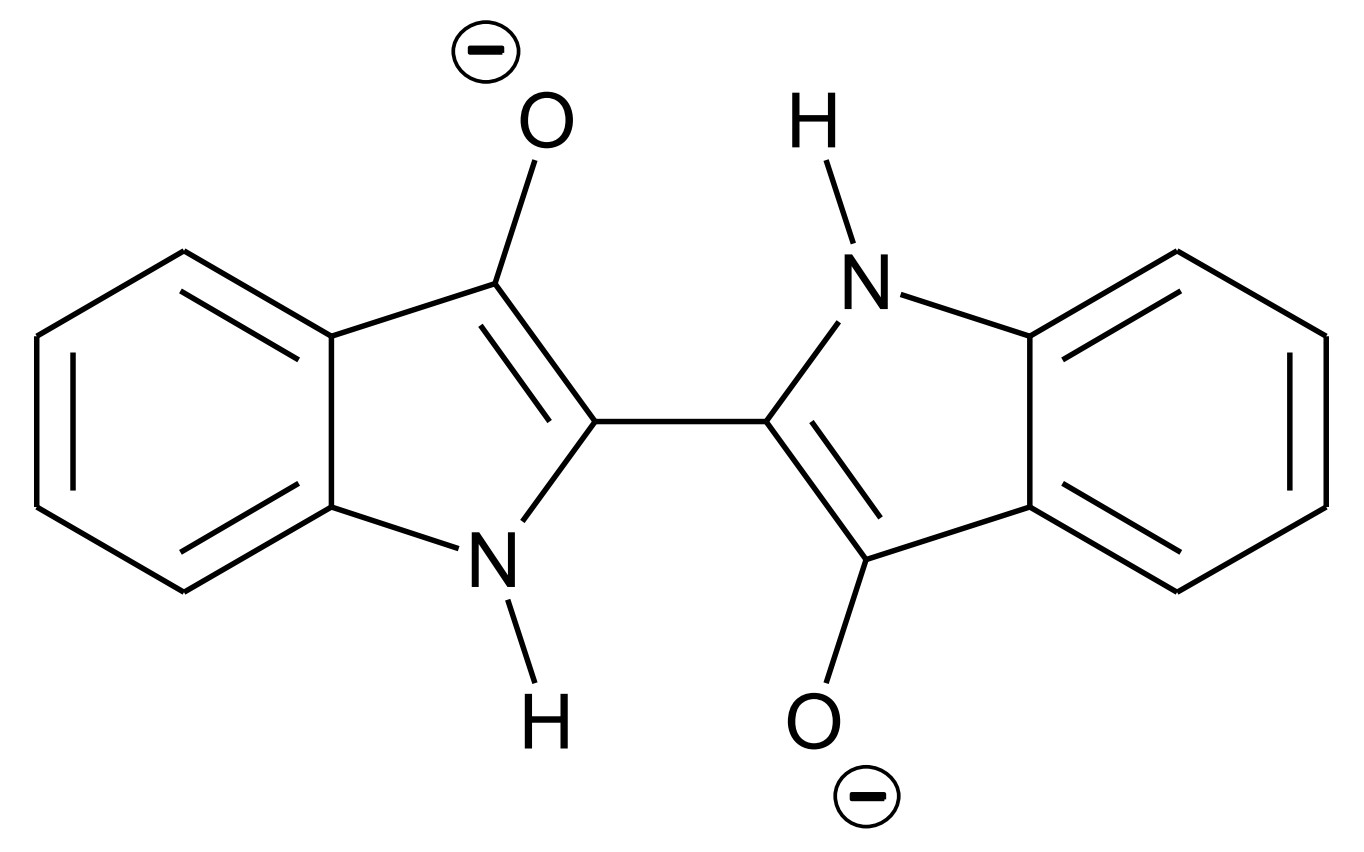
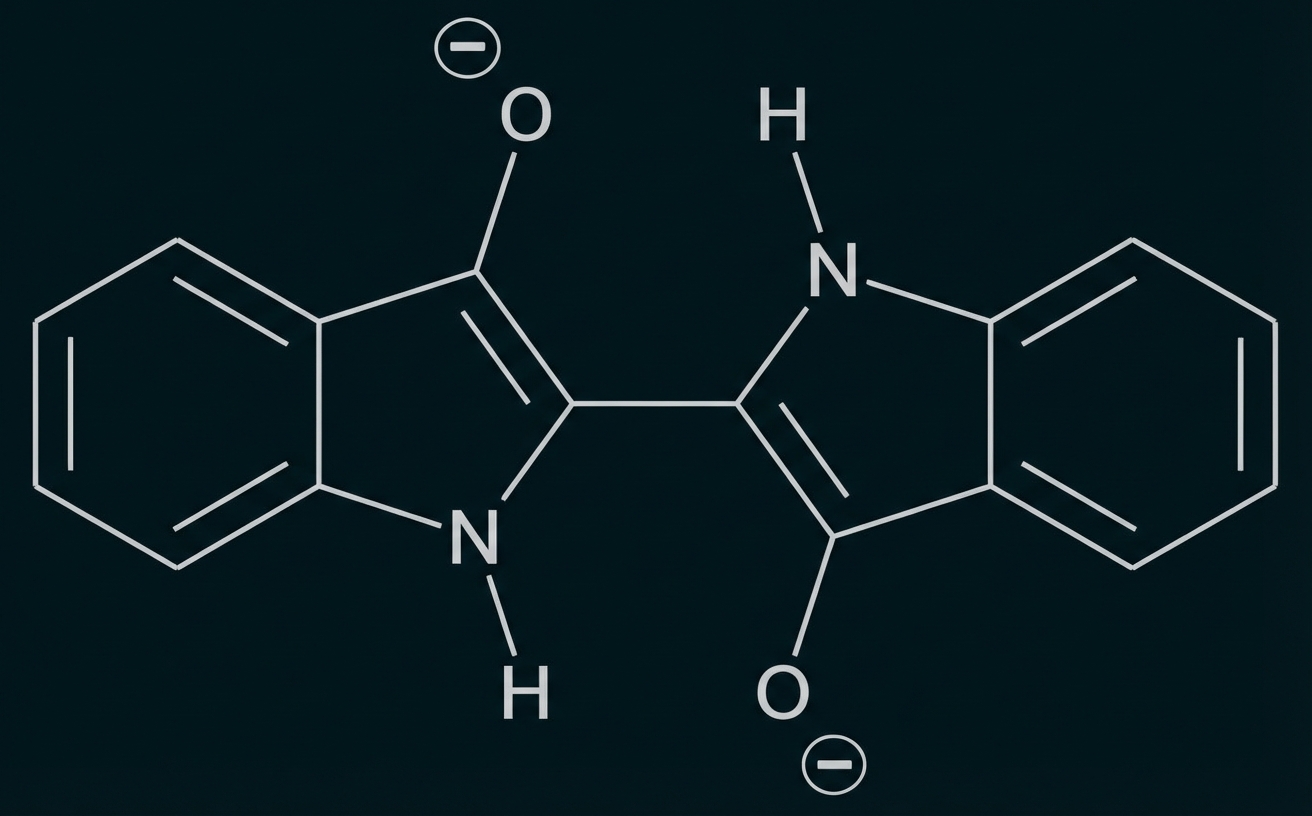
Abb. 2: Strukturformel von Leukoindigo
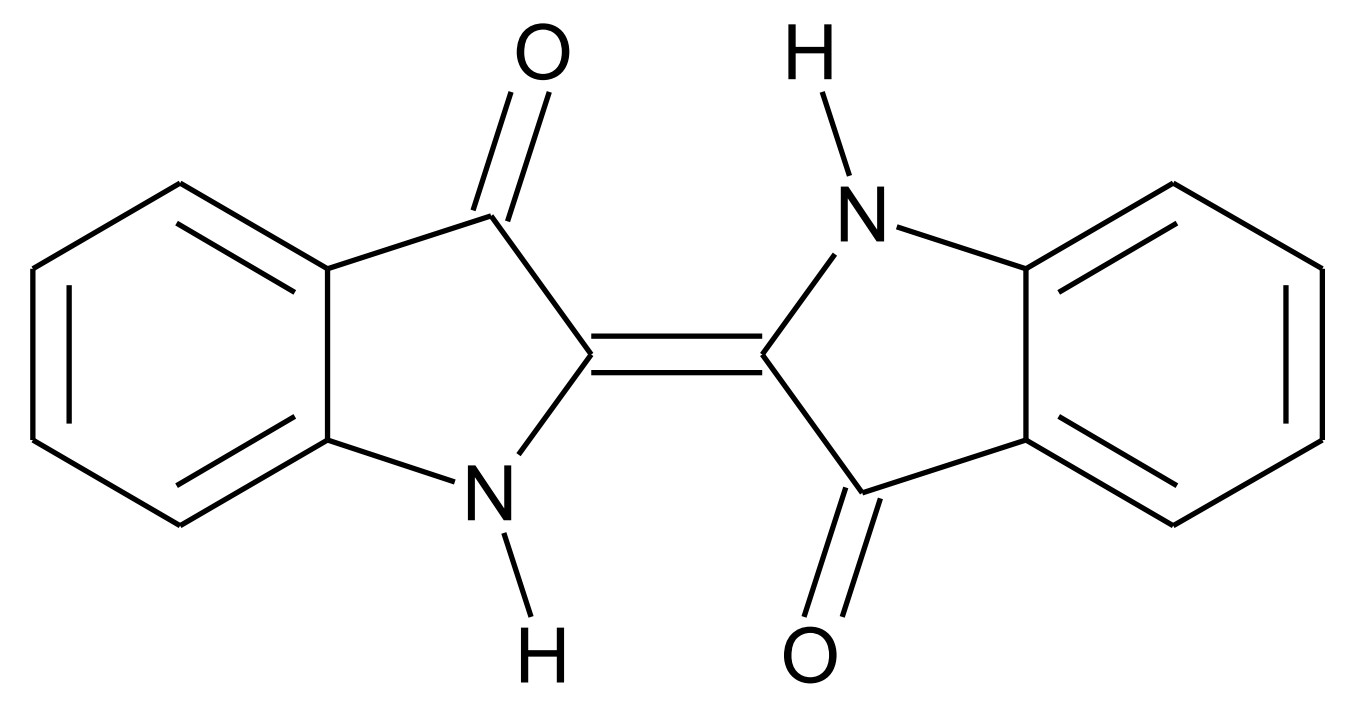
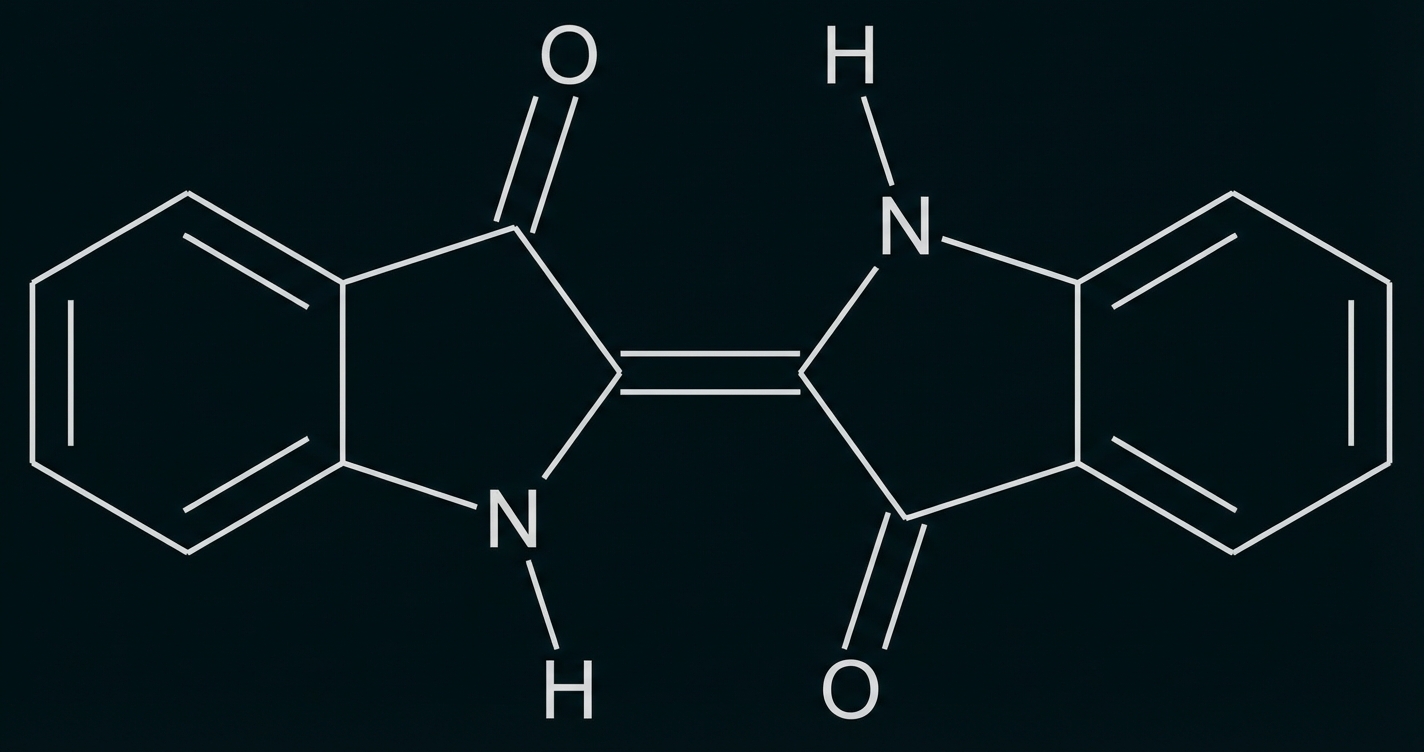
Abb. 1: Strukturformel von Indigo
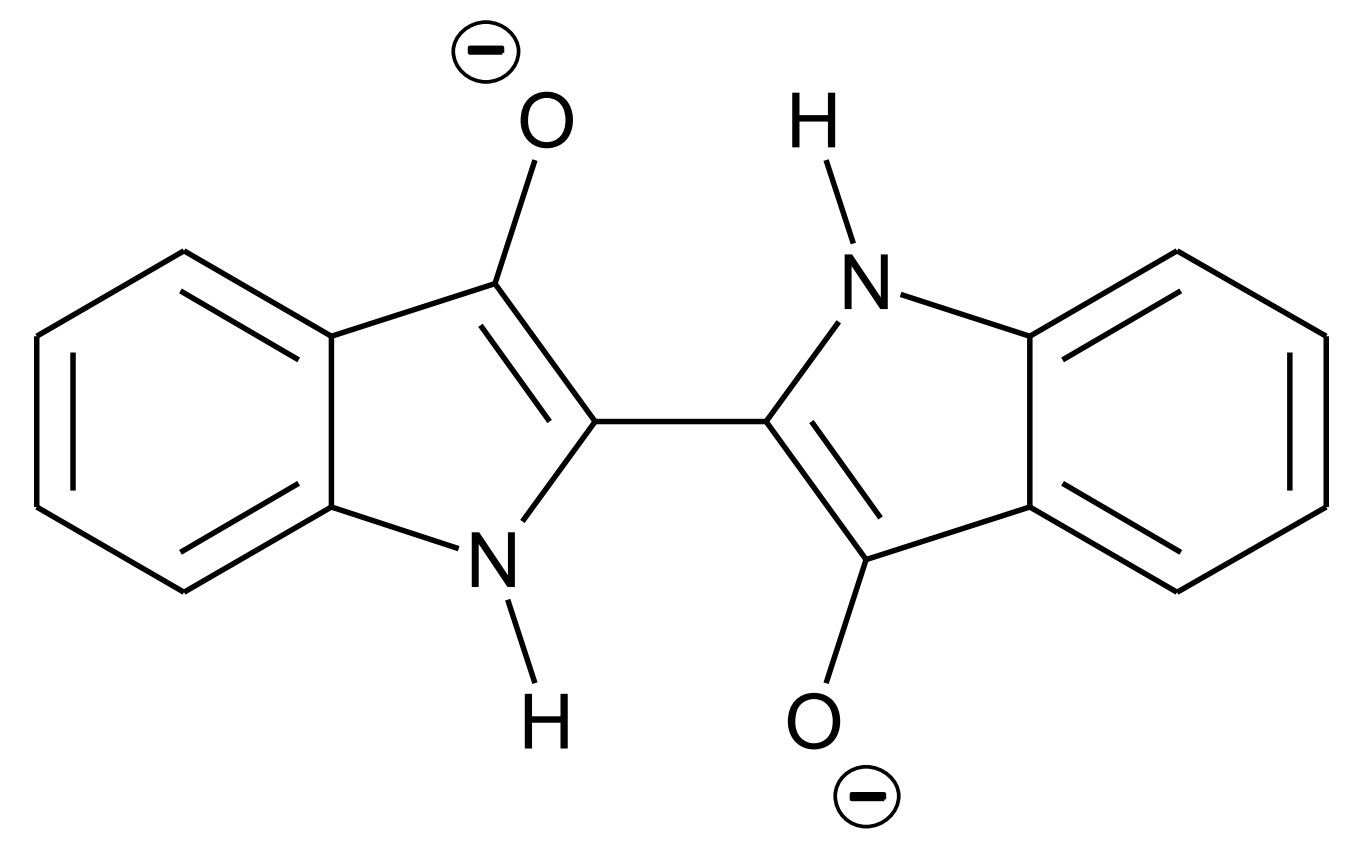
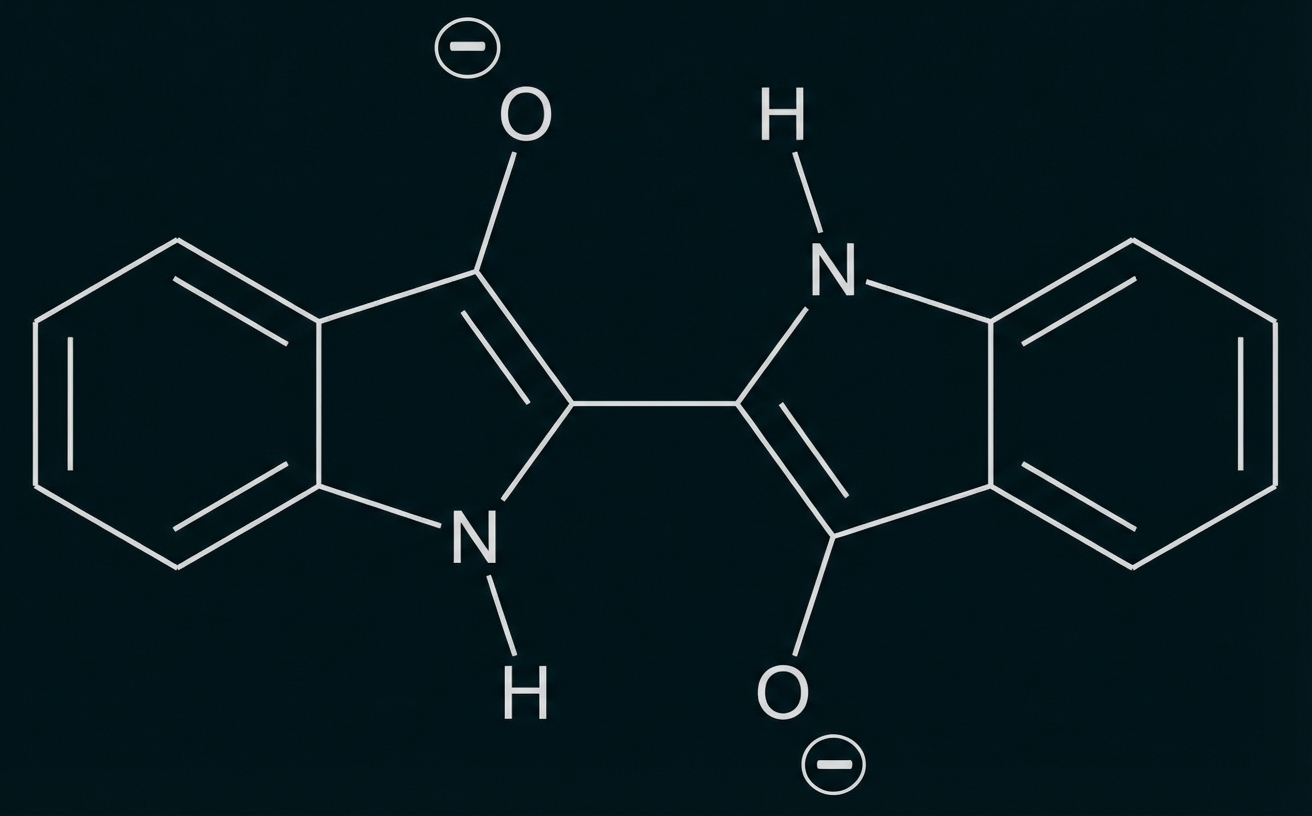
Abb. 2: Strukturformel von Leukoindigo
Um Absorptionsspektren von Farbstoffen erstellen zu können, müssen Stoffe in gelöster Form vorliegen. Indigo löst sich nur schlecht in Wasser, aber gut in Dimethylformamid. Das Lösemittel hat kaum Einfluss auf das Absorptionsspektrum. Abbildung 3 zeigt die Absorptionsspektren von Indigo und Leukoindigo in Dimethylformamid.
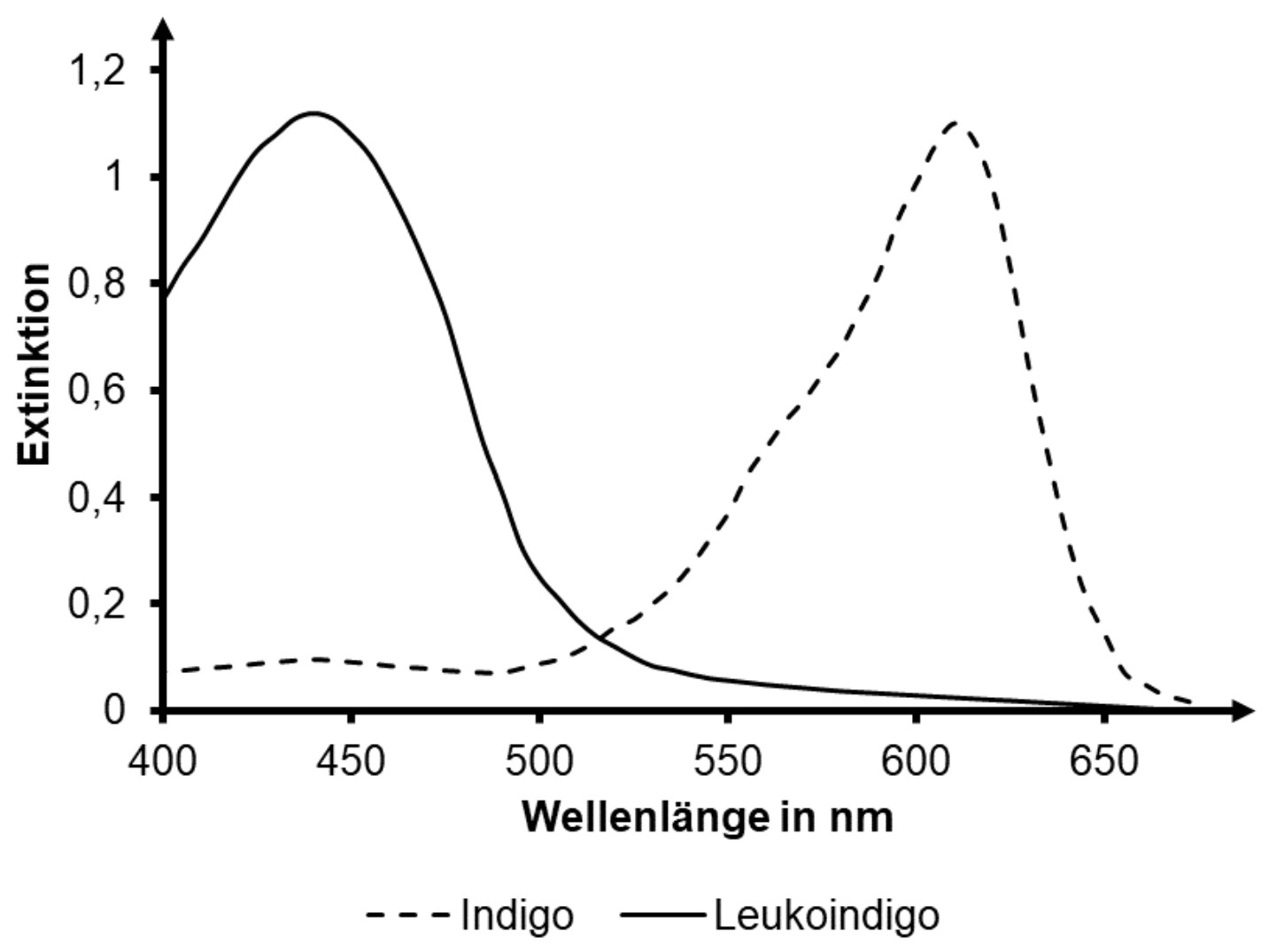
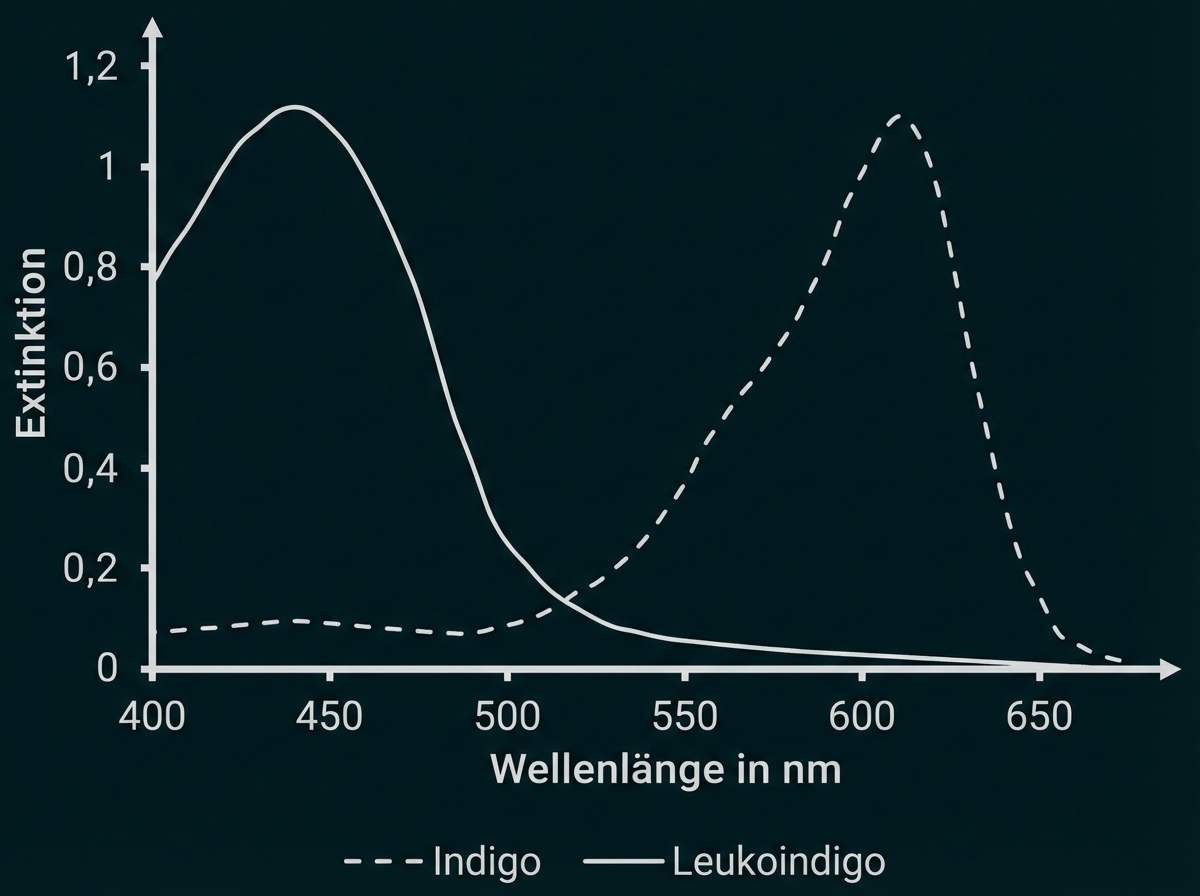
Abb. 3: Absorptionsspektren von Indigo und Leukoindigo in Dimethylformamid1
Material 2: Säurerot
Bei Säurerot handelt es sich um eine Klasse von Farbstoffen, die bei niedrigen pH-Werten auf Fasern aufgetragen werden. So lassen sich mit z. B. Säurerot 73, einem Vertreter dieser Farbstoffklasse, u. a. Wolle, Seide oder Polyamidfasern färben. In neutraler Lösung liegt Säurerot 73 fast ausschließlich als Anion vor.
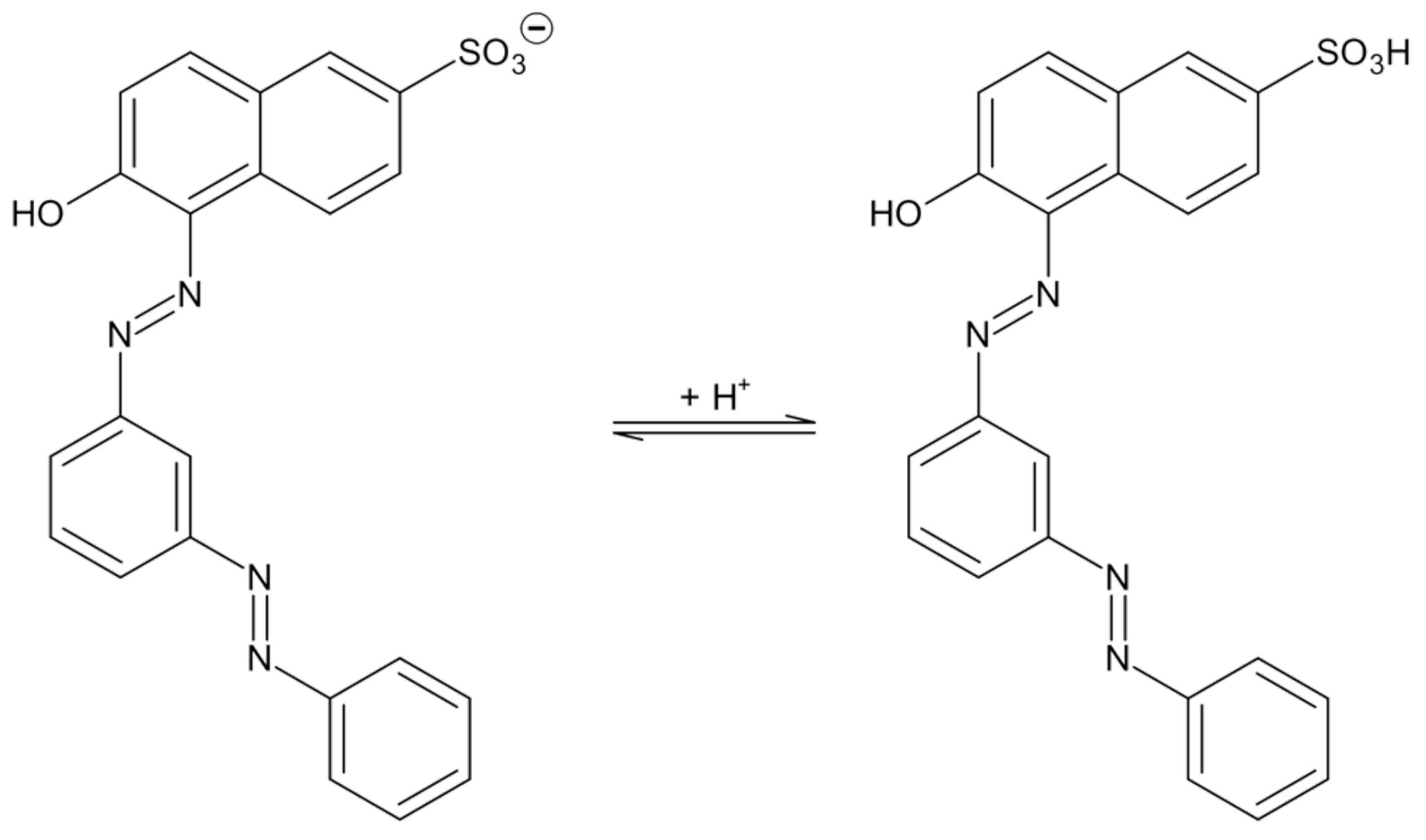
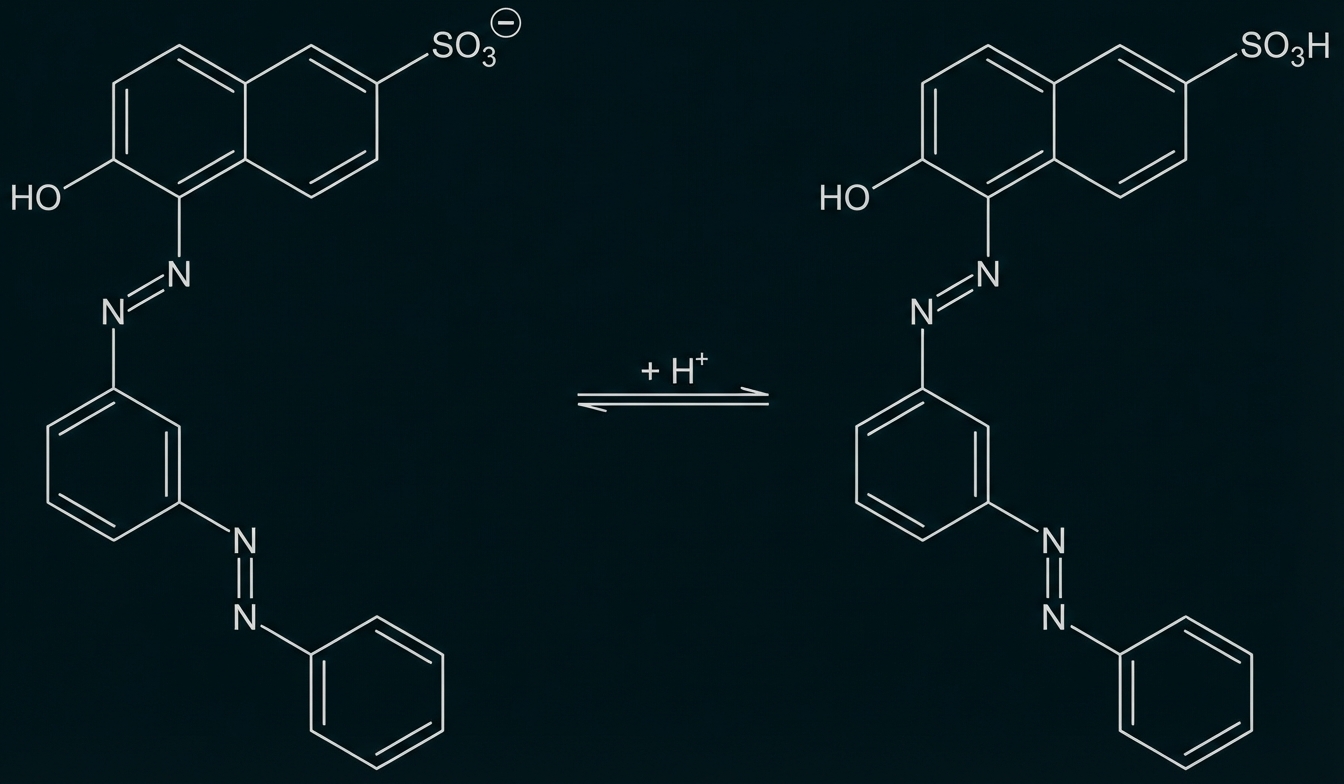
Abb. 4: Säure-Base-Gleichgewicht bei Säurerot 73
Um eine unerwünschte Verschmutzung von Gewässern durch Färbereiabwässer, die Säurerot-Farbstoffe enthalten, zu verhindern, gibt es mehrere Verfahren wie z. B.:
1) Nanofiltration:
Hierbei wird Abwasser durch eine spiralförmig gewundene Membran mit sehr feinen Poren gepresst. Wasser-Moleküle können die Membran im Gegensatz zu Farbstoff-Molekülen passieren. Je weiter die Lösung durch die Spirale strömt, desto weniger Lösungsmittel ist in ihrem Inneren vorhanden, wodurch die Konzentration der gelösten Stoffe ansteigt (Abb. 5). Über 90 % des gelösten Säurerots kann so abgetrennt werden. Die verwendete Membran hat eine Haltbarkeit von mehreren Jahren und besteht aus verschiedenen Schichten.
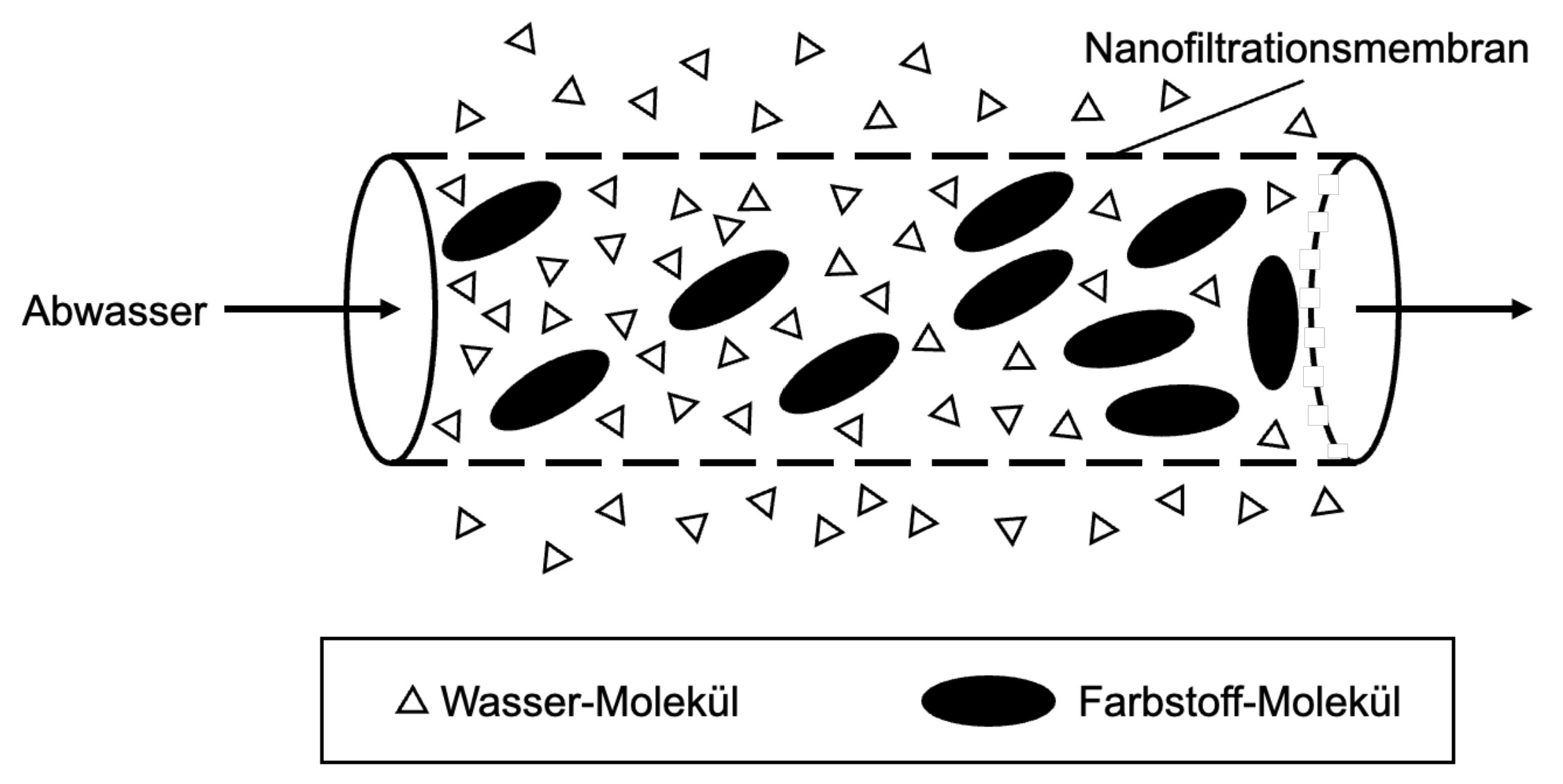
Abb. 5: schematische Darstellung der Nanofiltration2
Bei den in der Membran eingesetzten Kunststoffen handelt es sich zum einen um ein Aramid (Abb. 6), das duroplastische Eigenschaften aufweist, zum anderen um ein thermoplastisches Polysulfon (Abb. 7).
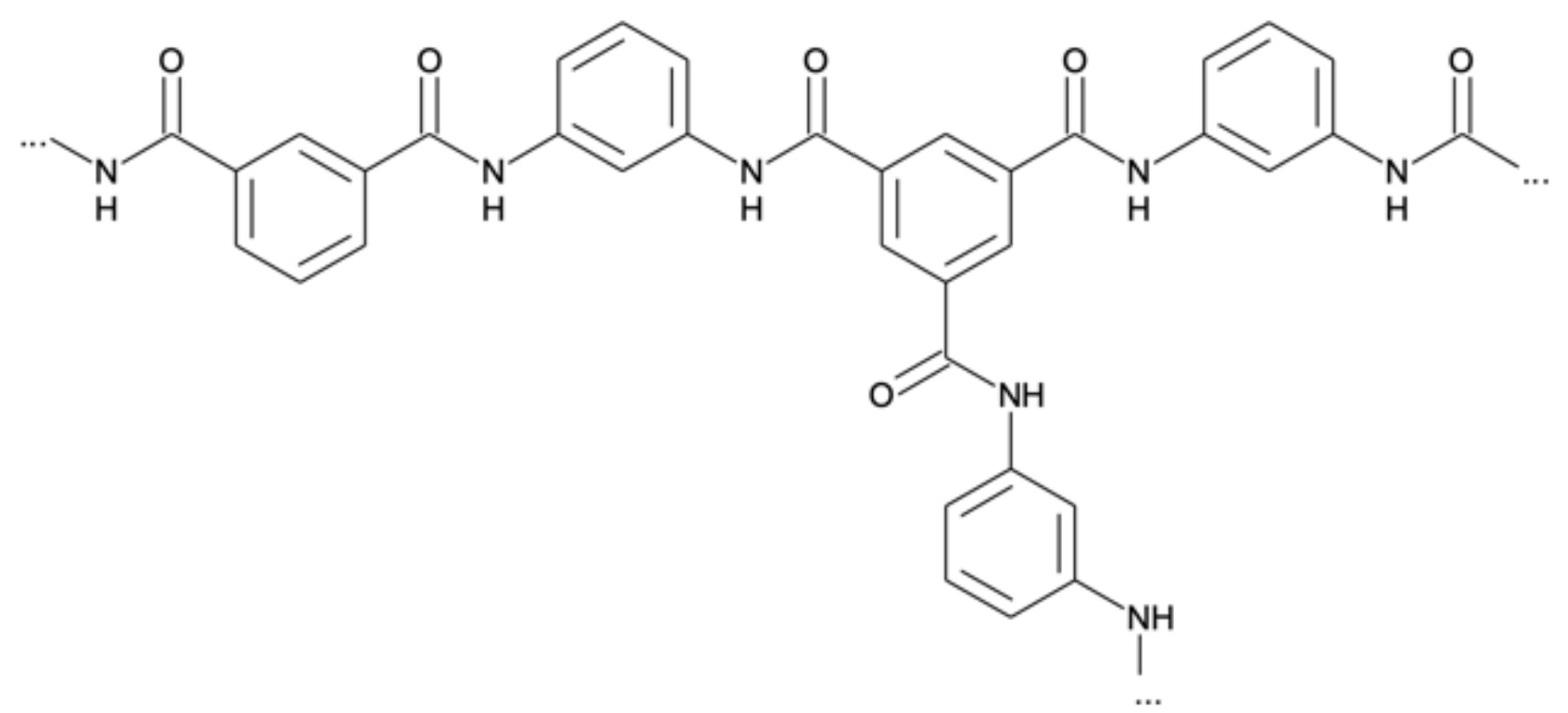
Abb. 6: Ausschnitt aus einem Aramid-Molekül
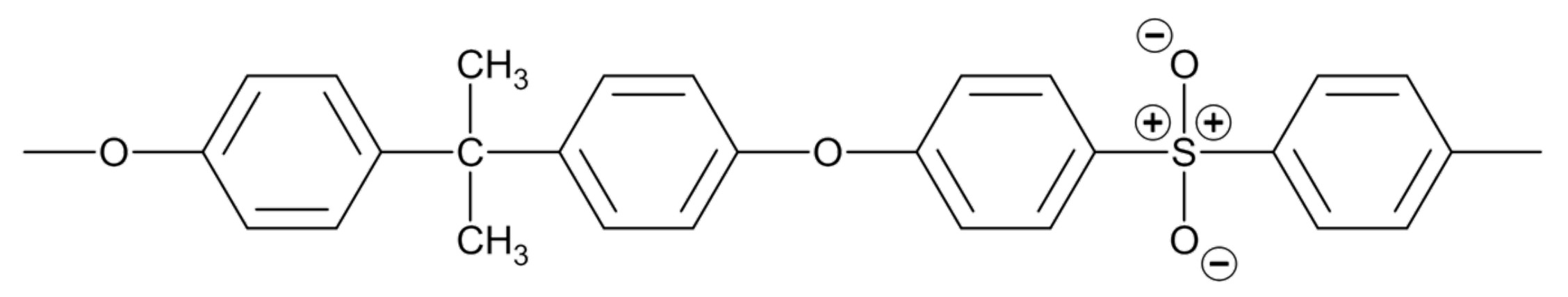
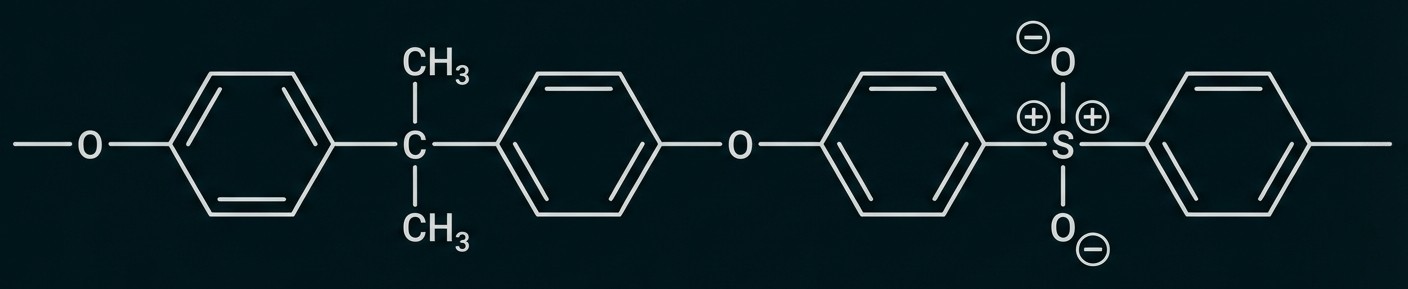
Abb. 7: Ausschnitt aus einem Polysulfon-Molekül
2) Adsorption3:
Das Abwasser wird z. B. durch organisches Material wie den als Abfallprodukt bei der Herstellung von Reiswein anfallenden Bodensatz geleitet. Dabei lagert sich der Farbstoff über Wechselwirkungen an die Oberfläche des Adsorptionsmittels an und wird so gebunden. Experimente zeigen, dass man bei ausreichenden Mengen Adsorptionsmittel über 98 % des im Abwasser gelösten Farbstoffs binden kann. Pro Gramm Adsorptionsmittel lassen sich bis zu Farbstoff aufnehmen. Das Material mit dem gebundenen Farbstoff muss anschließend entsorgt werden.
Zur Anlagerung von Säurerot 73 an den Reisweinbodensatz gibt es die Hypothese, dass positiv geladene Teilchen auf der Oberfläche des Adsorptionsmittels für die Fixierung des Farbstoffs verantwortlich sind.
Quellen:
1 De Melo, J. S. S., Moura, A. a. P., & Melo, M. J. (2004). Photophysical and spectroscopic studies of indigo derivatives in their keto and leuco forms. Journal of Physical Chemistry A, 108(34), 6975–6981. https://doi.org/10.1021/jp049076y
2 Abid, M. F., Zablouk, M. A., & Abid-Alameer, A. M. (2012). Experimental study of dye removal from industrial wastewater by membrane technologies of reverse osmosis and nanofiltration. Iranian Journal of Environmental Health Science & Engineering, 9(1). https://doi.org/10.1186/1735-2746-9-17
3 Wang, Q., Liang, L., Xi, F., Tian, G., Mao, Q., & Meng, X. (2020). Adsorption of Azo Dye Acid Red 73 onto Rice Wine Lees: Adsorption Kinetics and Isotherms. Advances in Materials Science and Engineering, 2020, 1–8. https://doi.org/10.1155/2020/3469579
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?Strahlung wird absorbiert, wenn ihre Energie ausreicht, um ein Elektron aus der höchsten besetzten Energiestufe (HOMO) in die niedrigste unbesetzte Energiestufe (LUMO) anzuregen. Liegt die Wellenlänge der absorbierten Strahlung im sichtbaren Bereich, so ist der Stoff farbig.
Zeichnung des Energiestufenschemas:
Das Absorptionsspektrum zeigt Absorptionsmaxima für Indigo bei ca. und für Leukoindigo bei ca.
Indigo absorbiert damit orange-rotes Licht am stärksten und erscheint damit in der Komplementärfarbe Blau.
Leukoindigo absorbiert am stärksten violett-blaues Licht und erscheint damit gelb-orange.
Bestimmung der Oxidationszahlen beider Moleküle:
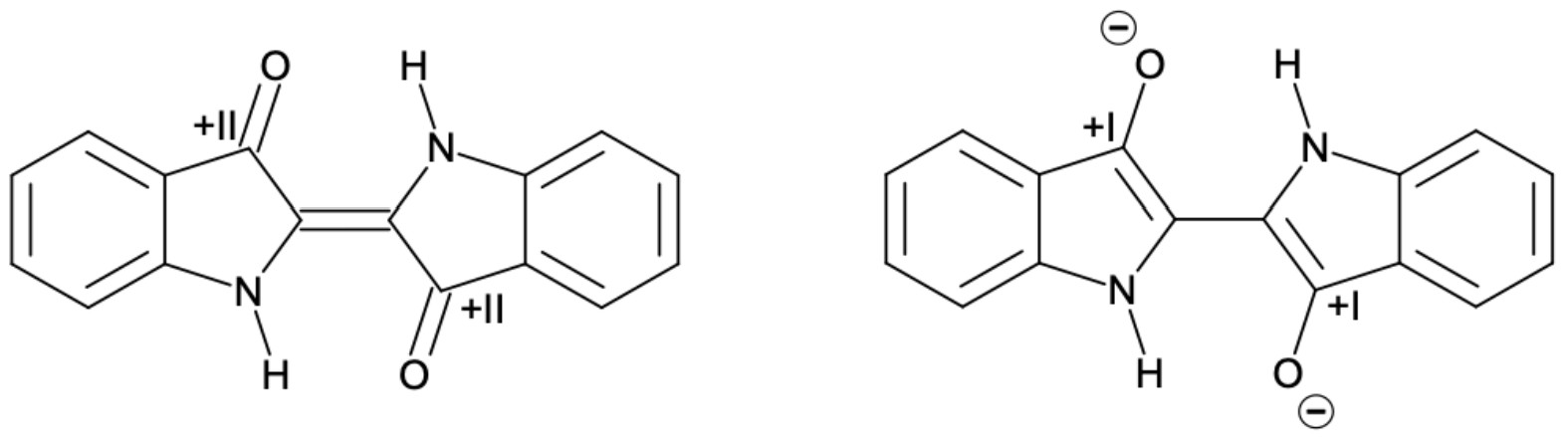
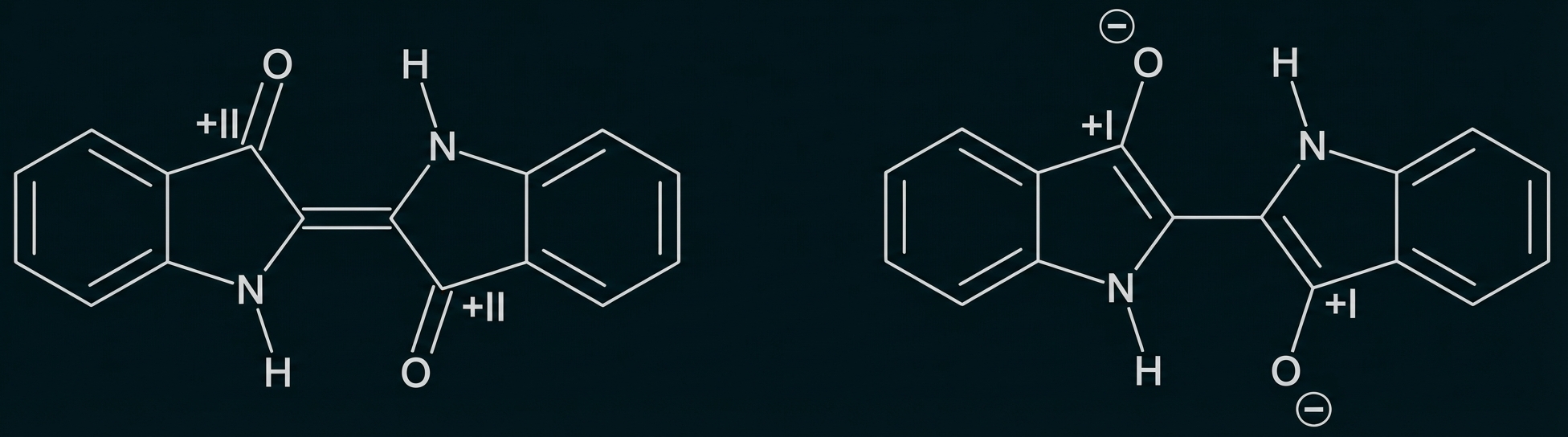
Es handelt sich um eine Redoxreaktion, weil sich die Oxidationszahlen ändern.
Indigo-Moleküle sind nicht geladen, während Leukoindigo-Moleküle zweifach negativ geladen sind. Daher lässt sich Leukoindigo gut in Wasser lösen und gelangt mit dem Lösemittel in die Zwischenräume der Faser.
Beim Trocknen wird Leukoindigo wieder zu Indigo oxidiert, das nicht mehr wasserlöslich ist und damit in der Faser verbleibt.
Das Aramid-Molekül weist Amidgruppen auf und wurde über eine Polykondensation hergestellt.
Als Monomere benötigt man 1,3-Diaminobenzol und Benzol-1,3,5-tricarbonsäure.
Das Aramid zersetzt sich bei Erhitzen, da aufgrund der Elektronenpaarbindungen keine Verschiebung der Moleküle möglich ist.
Das Polysulfon wird beim Erhitzen erst weich und schmilzt, bevor es sich zersetzt, da sich die Molekülketten gegeneinander verschieben lassen, wenn die Wechselwirkungen überwunden sind.
Säurerot liegt in neutralen Lösungen als Anion vor. Bei Zugabe von Säure wird das Farbstoff-Molekül protoniert und ist damit nicht mehr geladen. Damit sollten die Anziehungskräfte durch positive Ladungen auf der Oberfläche des Adsorptionsmittels im Sauren geringer sein, also weniger Farbstoff gebunden werden.
Experiment, z. B.:
Es werden zwei Versuchsansätze mit identischer Farbstoffkonzentration und gleichen Mengen Adsorptionsmittel hergestellt. Bei einem Ansatz wird ein neutraler, beim anderen ein saurer pH-Wert eingestellt. Nach Durchmischen wird die verbliebene Farbstoffkonzentration in der Lösung ermittelt.
Wenn die verbliebene Farbstoffkonzentration im Ansatz mit saurer Lösung höher liegt als im Ansatz mit neutraler Lösung, ist die Hypothese gestützt, anderenfalls ist sie widerlegt.
Die Kunststoffmembranen bei der Nanofiltration werden aus fossilen Rohstoffen hergestellt und sind demnach nicht besonders nachhaltig. Der Bodensatz aus der Reisweinproduktion ist ein nachwachsender Rohstoff.
Allerdings ist die Haltbarkeit der Membran relativ hoch und sie muss, wenn keine Beschädigungen auftreten, lange nicht ausgetauscht werden, während der Reisweinbodensatz aufgrund der begrenzten Adsorptionsfähigkeit entweder in relativ kurzen Abständen ausgetauscht werden muss bzw. in großen Mengen benötigt wird.
Die Menge an Abfällen nimmt bei der Adsorption zu, weil nicht nur der Farbstoff, sondern auch das verwendete Adsorptionsmittel entsorgt werden müssen. Bei der Nanofiltration fällt eine Lösung mit relativ hoher Konzentration an Schadstoffen an, womit die Abfallmenge eher niedrig ist.
Abschließendes Urteil:
Z. B.: Die Nanofiltration ist wahrscheinlich nachhaltiger ist als die Adsorption mittels Pflanzenmaterial.