A4 – Einflüsse von Kohlenwasserstoffen auf Umwelt und Atmosphäre
Die Verwendung von Kohlenwasserstoffen und von ihnen abgeleiteten Verbindungen beeinflusst das Klima und kann auch Schäden bei Organismen hervorrufen.
Beschreibe die Durchführung der Bromwasserprobe mit Isopren und Methan unter Verwendung einer Skizze. Erkläre jeweils die Beobachtungen. Begründe anhand des Reaktionsmechanismus die Bildung des Nebenprodukts. (M 1)
Berechne mithilfe der Reaktionsgleichungen jeweils die Standardreaktionsenthalpie der Verbrennungsreaktionen von Methan und Propan. Erkläre den Zusammenhang zwischen den berechneten Standardreaktionsenthalpien und den in Tab. 2 gegebenen Brennwerten. (M 2)
Interpretiere die Abbildungen 3 und 4 unter Zuhilfenahme des Textes. (M 3)
Stelle die Modellvorstellung in Abbildung 5 als Reaktionsgleichungen in Valenzstrichformelschreibweise dar. Gib je einen Vorteil der beiden Darstellungsweisen an. Beurteile, inwieweit die Modellvorstellung durch die Messwerte in Abbildung 3 und 4 gestützt wird. (M 3)
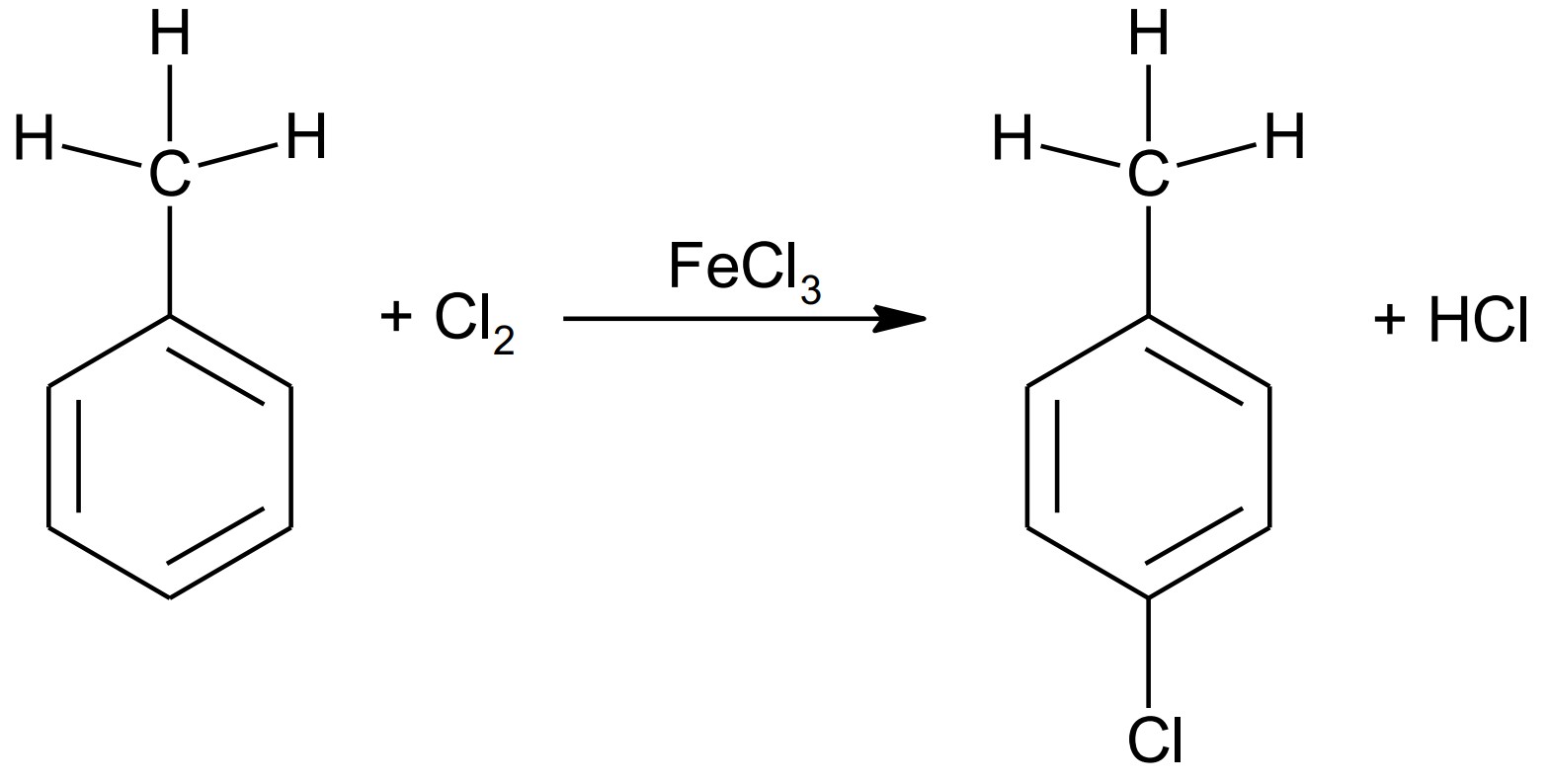
Beurteile, ob sich mit den angegebenen Stoffen 4-Chlortoluol herstellen lässt. Leite jeweils die für die Herstellung von 4-Chlortoluol sowie Benzylchlorid notwendigen Reaktionsbedingungen unter Angabe der Reaktionsgleichungen ab. Nenne die Namen der entsprechenden Reaktionsmechanismen. (M 4)
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?Material 1: Kohlenwasserstoffe – von der Erde in die Atmosphäre
In der Atmosphäre reagiert eine Vielzahl von Stoffen mit Ozon. Zwei Kohlenwasserstoffe, die unter anderem durch natürliche Quellen freigesetzt werden, sind Isopren und Methan. In der Natur wird Isopren (2-Methylbuta-1,3-dien) von grünen Pflanzen freigesetzt. Methan wird z. B. von Bakterien in den Mägen von Wiederkäuern produziert und von den Tieren in die Atmosphäre abgegeben.
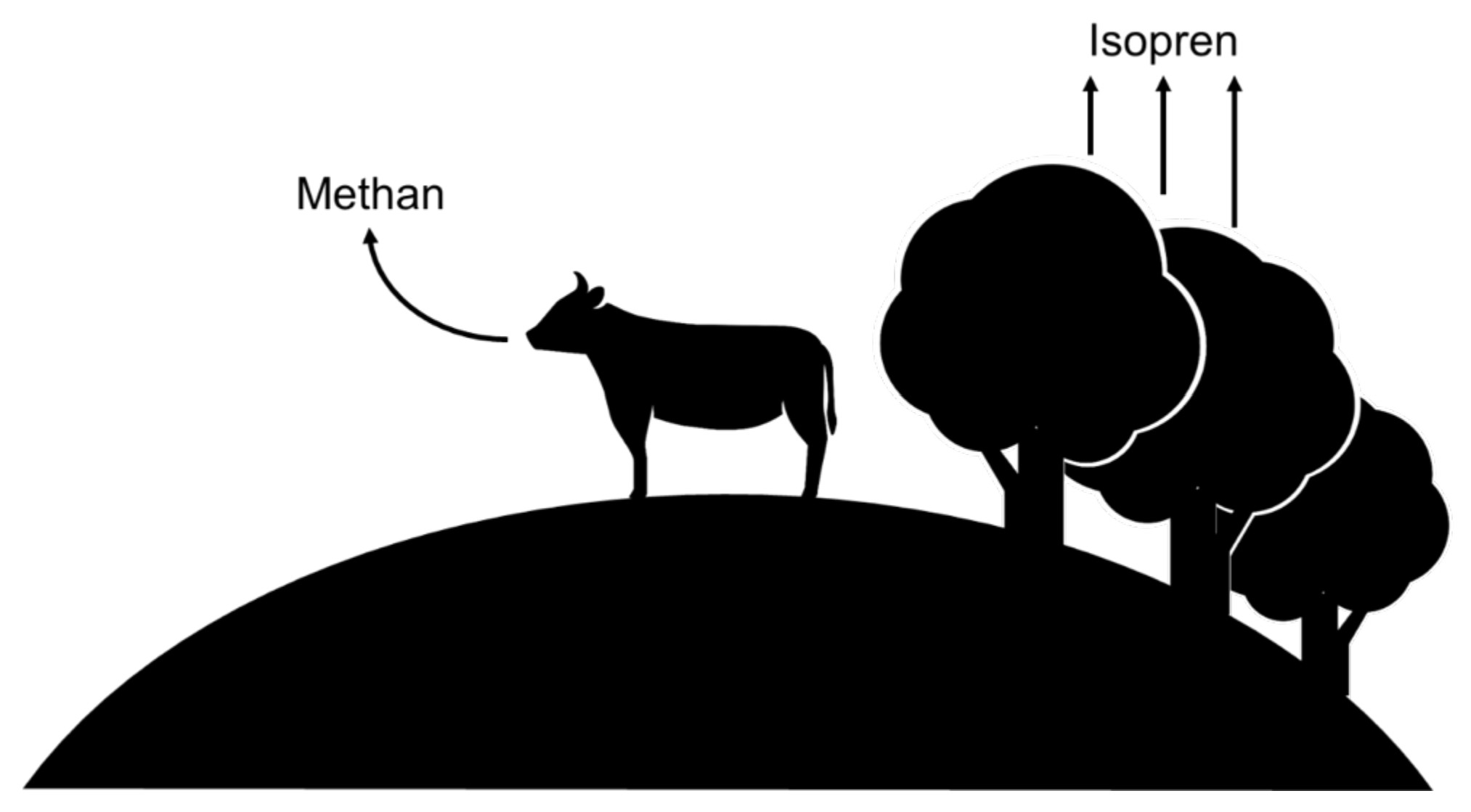
Abb. 1: Freisetzung von Isopren und Methan in die Atmosphäre
Sowohl mit Isopren als auch mit Methan wird die Bromwasserprobe durchgeführt. Mit Isopren entsteht als Nebenprodukt u. a. die in Abb. 2 dargestellte Verbindung:
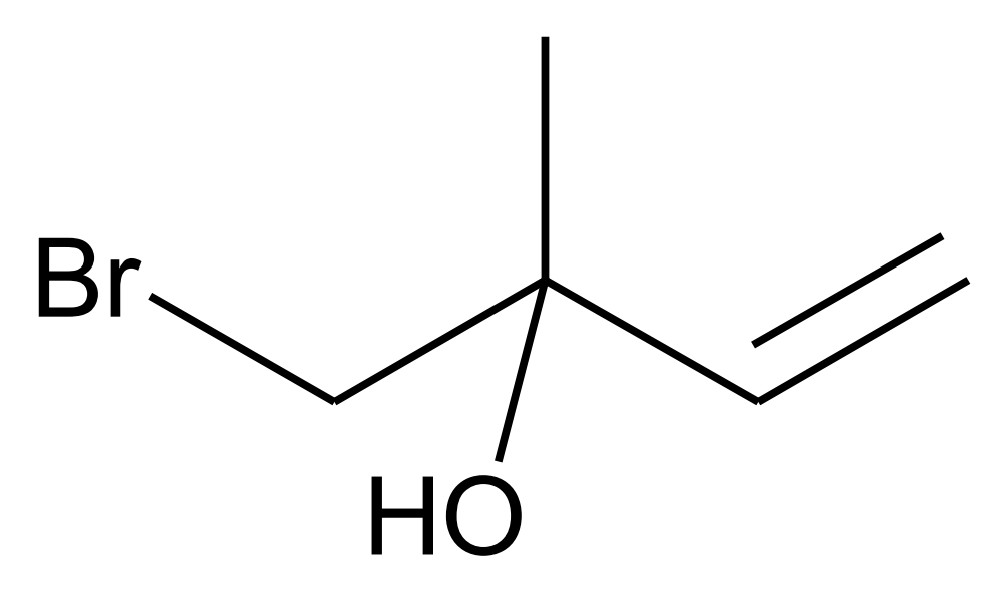
Abb. 2: Strukturformel des Nebenprodukts
Material 2: Heizen und Bewegen mit Kohlenwasserstoffen
Die Verbrennung von Kohlenwasserstoffen hat einen wesentlichen Einfluss auf die Atmosphäre. Erdgas, dessen Hauptbestandteil Methan ist (im Nordsee-Erdgas 89 %), wird u. a. zum Heizen von Wohnungen oder zum Antrieb von Pkw genutzt.
Anstelle von Erdgas wird vermehrt auch Flüssiggas sowohl beim Heizen als auch in Pkw eingesetzt. Flüssiggas ist ein Gemisch aus unter hohem Druck verflüssigtem Propan (95 %), Butan (4 %) und weiterer Kohlenwasserstoffe (1 %).
Tab. 1: Standardbildungsenthalpien ausgewählter Verbindungen1
|
Verbindung |
molare Standardbildungsenthalpie |
|
Methan |
|
|
Wasser |
|
|
Propan |
|
|
Kohlenstoffdioxid |
|
Tab. 2: Brennwerte gasförmiger Brennstoffe bei einer Temperatur von 25 °C1
|
Brennstoff |
Brennwert in MJ/kg |
|
Methan |
|
|
Ethan |
|
|
Propan |
|
|
Butan |
|
Material 3: Trichlorfluormethan – ein CFKW
Neben Methan sind Chlorfluorkohlenwasserstoffe (CFKW) für den Abbau der Ozonschicht verantwortlich. Ein Vertreter dieser Gruppe ist Trichlorfluormethan, das früher als Kältemittel in Kühlschränken sowie als Treibgas für Spraydosen verwendet wurde. Freigesetztes Trichlorfluormethan verbleibt Jahrzehnte in der Atmosphäre und kann dort seine chemische Wirkung auf die Ozonschicht entfalten. Dieser Effekt wurde bereits in den 1980er Jahren erkannt.
Die Ozonschicht schwächt die für Organismen schädliche UV-Strahlung aus dem Weltall um ein Vielfaches ab. 1987 wurden im sogenannten Protokoll von Montreal internationale Vereinbarungen zum Schutz der Ozonschicht getroffen. Dabei verpflichteten sich die unterzeichnenden Staaten u. a. den Einsatz von Trichlorfluormethan zu verbieten. Seit dem Jahr 1991 wurde in der Bundesrepublik Deutschland die Verwendung von Trichlorfluormethan rechtlich stark eingeschränkt und der Stoff nach Möglichkeit ersetzt. Seit 2009 ist die Herstellung und Verwendung von Trichlorfluormethan in allen 197 Unterzeichnerstaaten verboten.
In Abbildung 3 sind die weltweit jährlich gemessene Freisetzung von Trichlorfluormethan sowie eine Prognose der Emissionen bei Einhaltung des Montreal-Protokolls dargestellt. Abbildung 4 zeigt die Dicke der Ozonschicht im zeitlichen Verlauf.
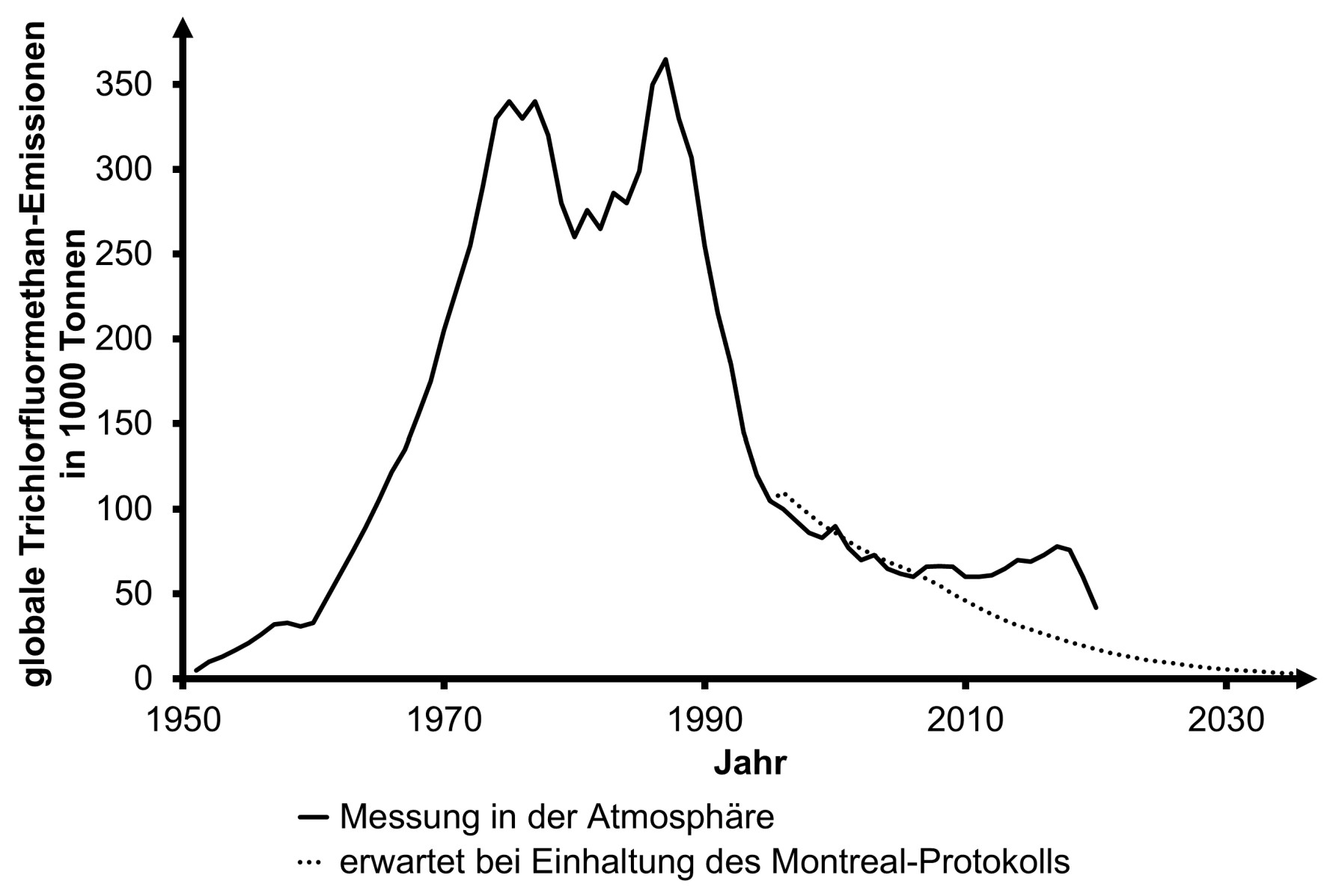
Abb. 3: zeitliche Entwicklung der globalen Emission von Trichlorfluormethan (gemessen in der Atmosphäre)2
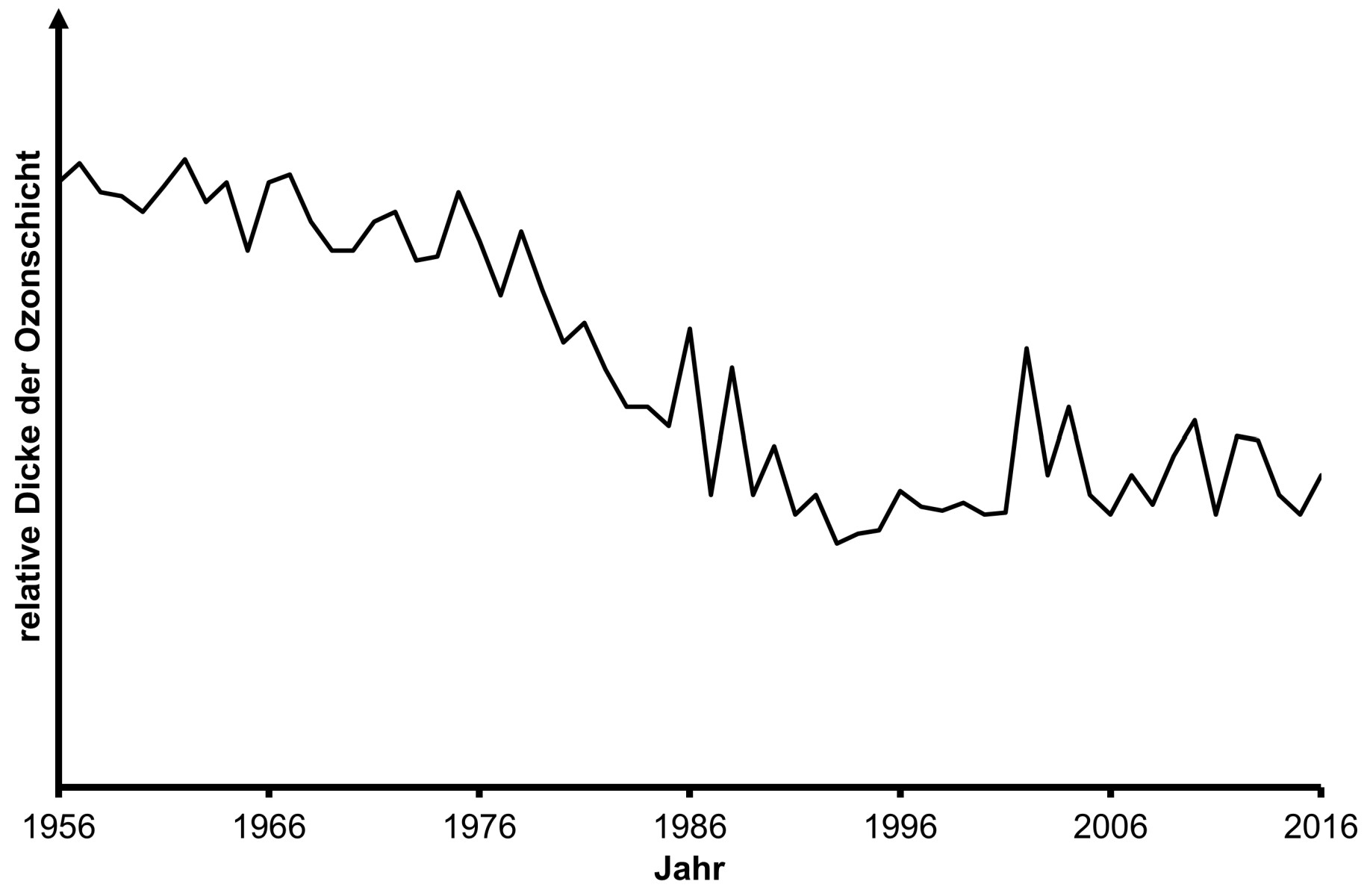
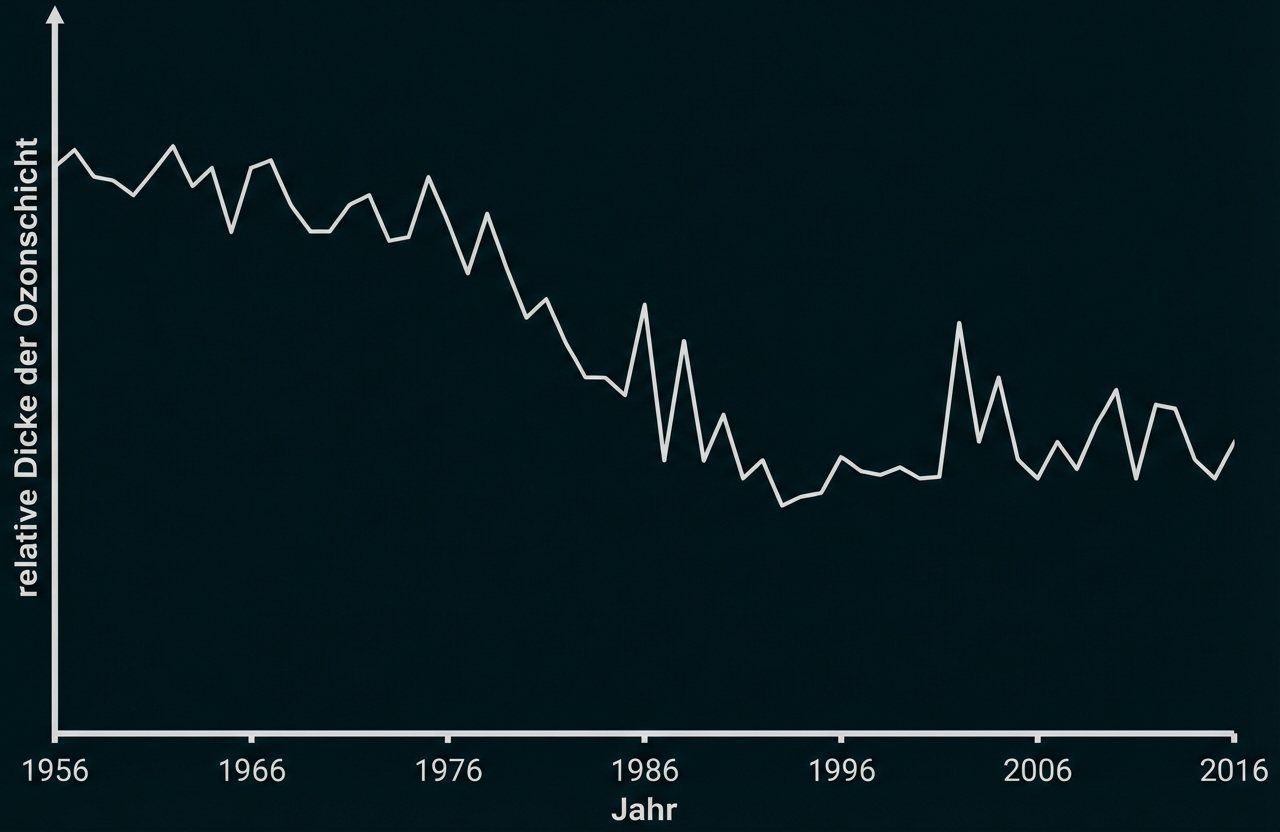
Abb. 4: zeitliche Entwicklung der Dicke der Ozonschicht3
Forscher haben den Zusammenhang zwischen Abbildung 3 und 4 auf Teilchenebene modelliert (Abb. 5).
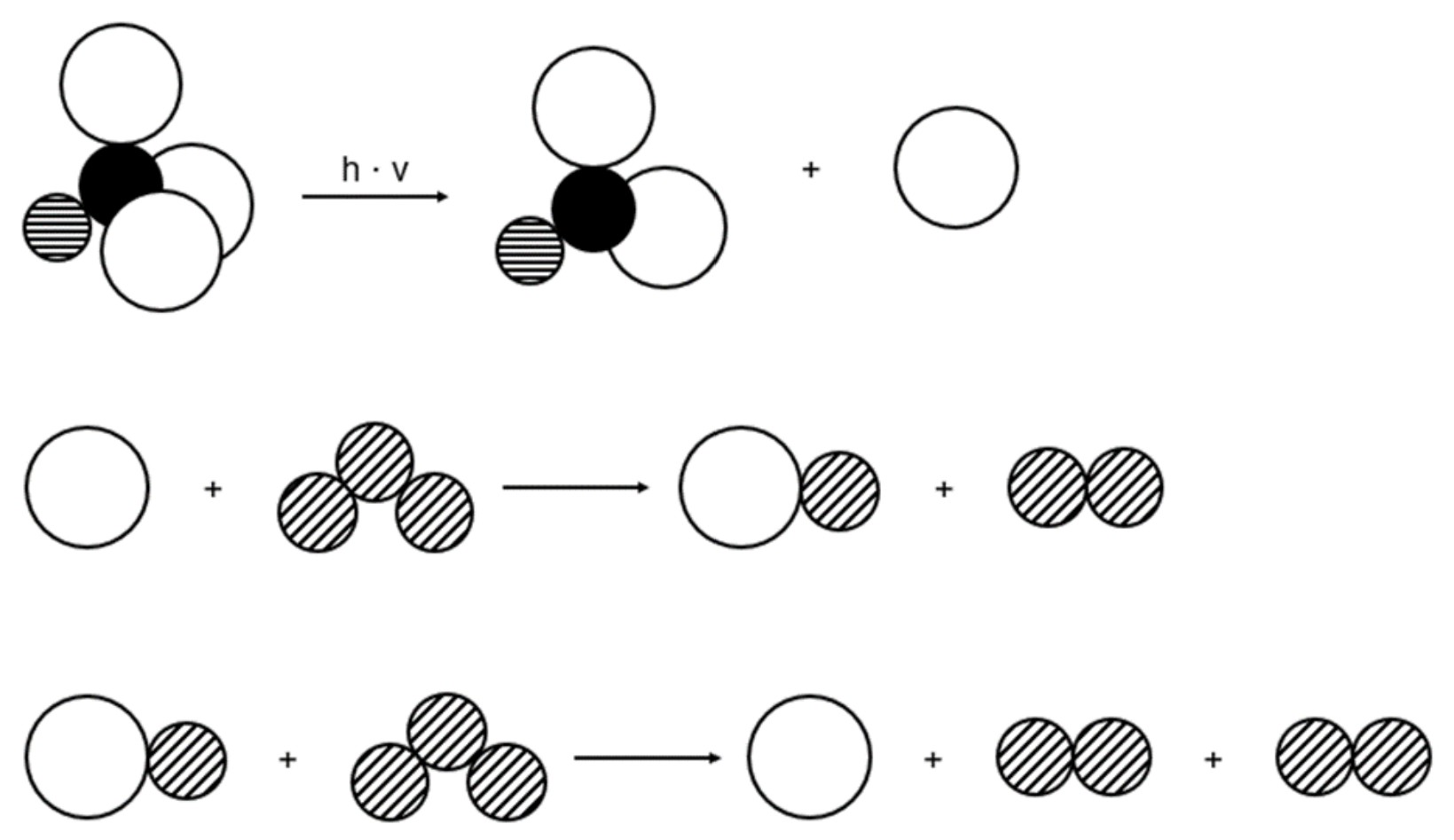
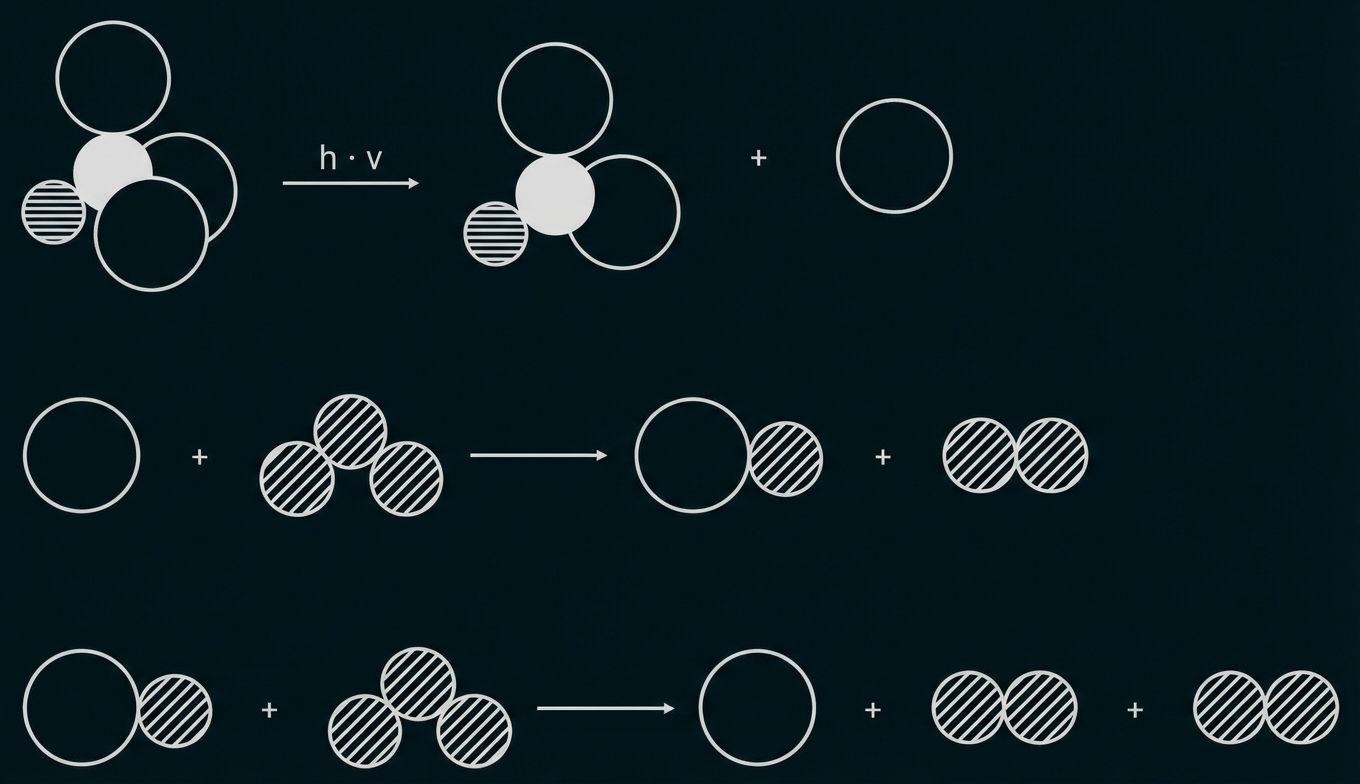
Abb. 5: Mechanismus zum Abbau von Ozon-Molekülen durch Trichlorfluormethan-Moleküle in einer Modellvorstellung4
Material 4: Toluol und chlorierte Aromaten
Weitere Beispiele für chlorierte Kohlenwasserstoffe, die Umweltschäden verursachen können, sind Chlortoluol und Benzylchlorid. Sie entstehen z. B. als Zwischenprodukte bei der Herstellung von Farbstoffen und Arzneimitteln.
Bei der Synthese bestimmter Farbstoffe reagiert Toluol mit Chlor. Je nach Reaktionsbedingungen und eingesetzten Edukten kann es zu 4-Chlortoluol oder Benzylchlorid (Abb. 6) umgesetzt werden.
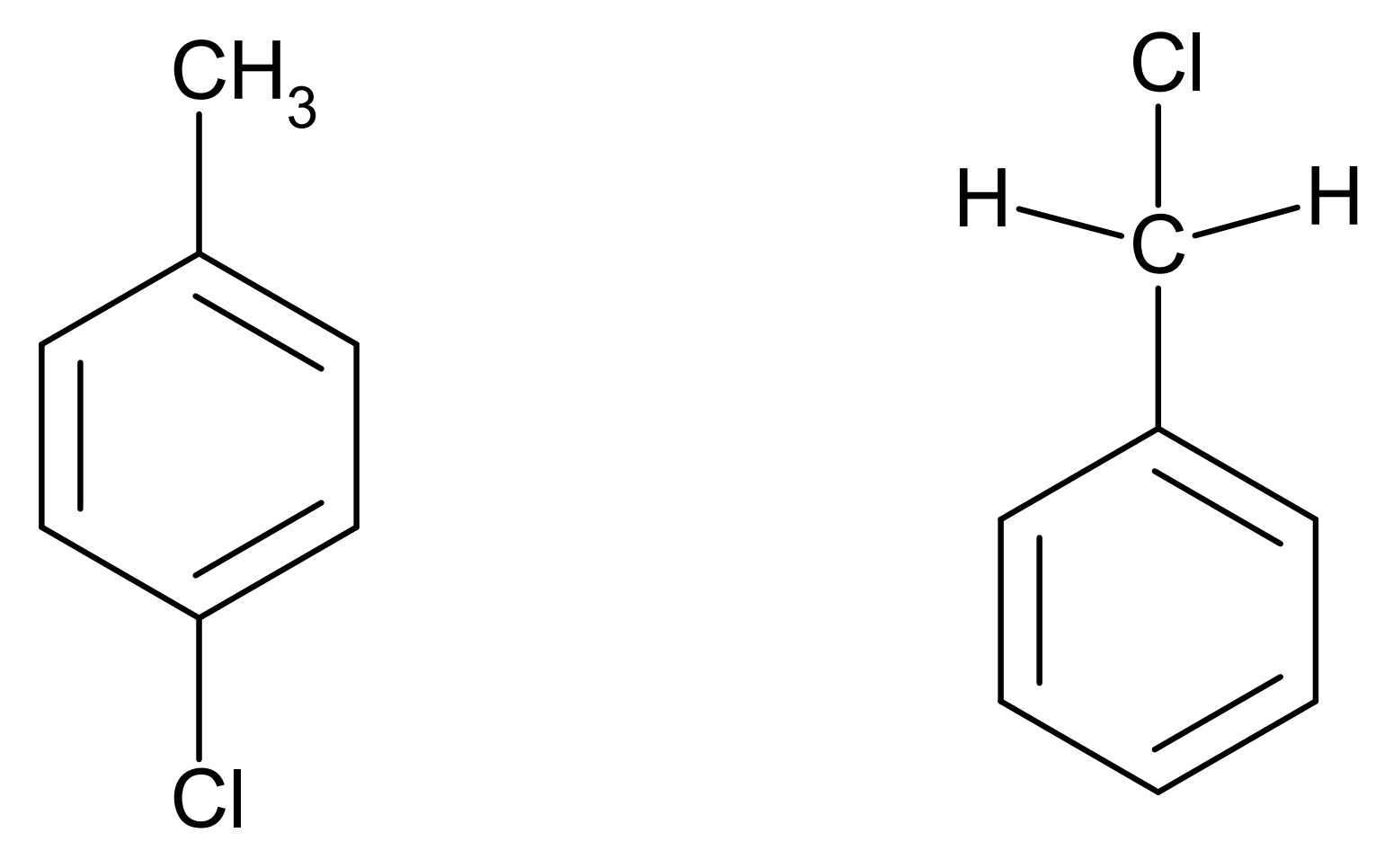
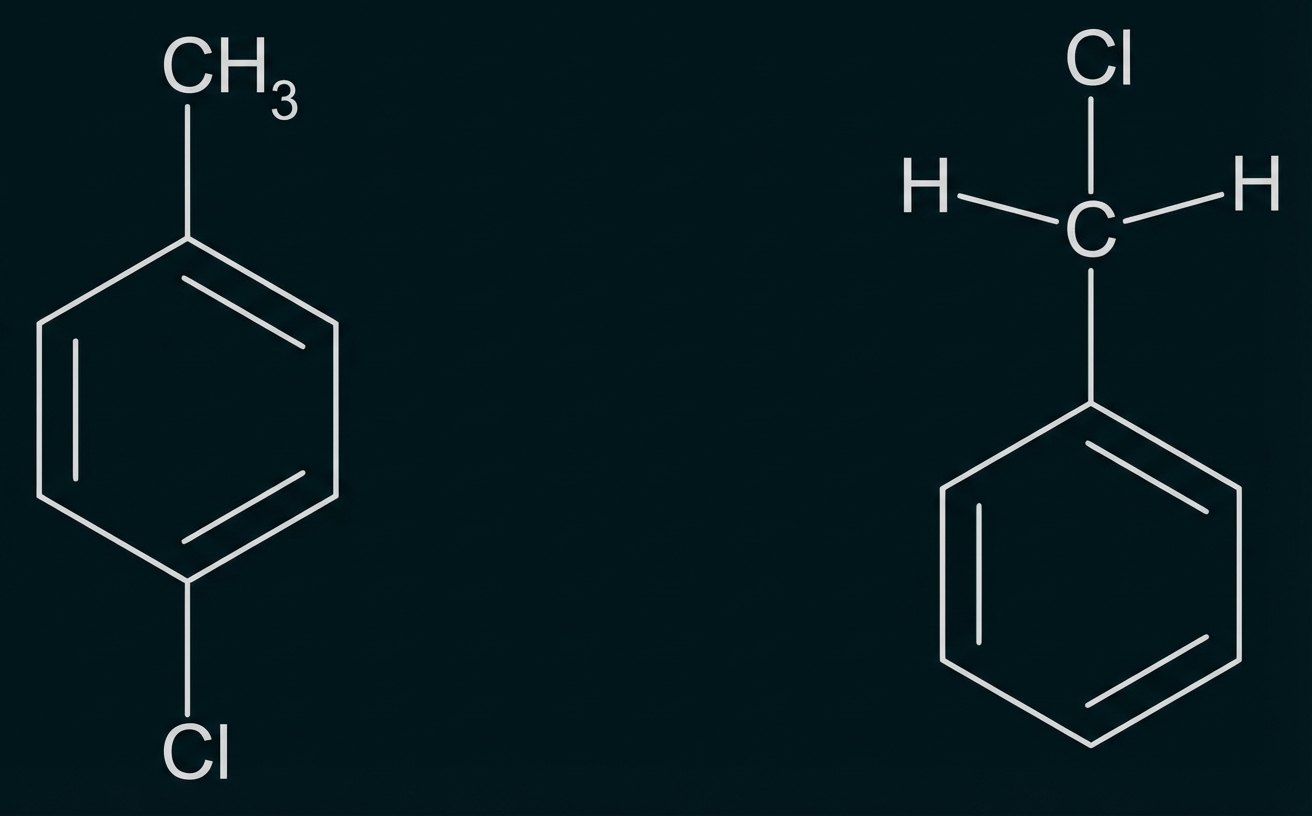
Abb. 6: Skelettformeln von 4-Chlortoluol (links) und Benzylchlorid (rechts)
Im Labor stehen für die Synthese, neben Toluol und Chlor, Eisen(III)-chlorid und Wasserstoffchlorid als Chemikalien zur Verfügung.
Quellen:
1 Wikipedia-Autoren. (2003). Heizwert. de.wikipedia.org. https://de.wikipedia.org/wiki/Heizwert
2 Gerbing, C. (2021b, February 11). Global CFC emissions now declining again as expected under the Montreal Protocol - Atmospheric Composition & Chemistry. Atmospheric Composition & Chemistry. https://research.csiro.au/acc/global-cfc-emissions-now-declining-again/
3 Allin, S., Laube, J., Witrant, E., Kaiser, J., McKenna, E. J., Dennis, P. F., Mulvaney, R., Capron, E., Martinerie, P., Röckmann, T., Blunier, T., Schwander, J., Fraser, P. J., Langenfelds, R. L., & Sturges, W. T. (2015). Chlorine isotope composition in chlorofluorocarbons CFC-11, CFC-12 and CFC-113 in firn, stratospheric and tropospheric air. Atmospheric Chemistry and Physics, 15(12), 6867–6877. https://doi.org/10.5194/acp-15-6867-2015
4 https://www.chemgeo.uni-jena.de/chegemedia/ituc/praktikum/ozonabbau.pdf
Weiter lernen mit SchulLV-PLUS!
monatlich kündbarSchulLV-PLUS-Vorteile im ÜberblickDu hast bereits einen Account?Durchführung Bromwasserprobe: Die beiden gasförmigen Kohlenwasserstoffe werden jeweils durch ein Gefäß mit Bromwasser geleitet.
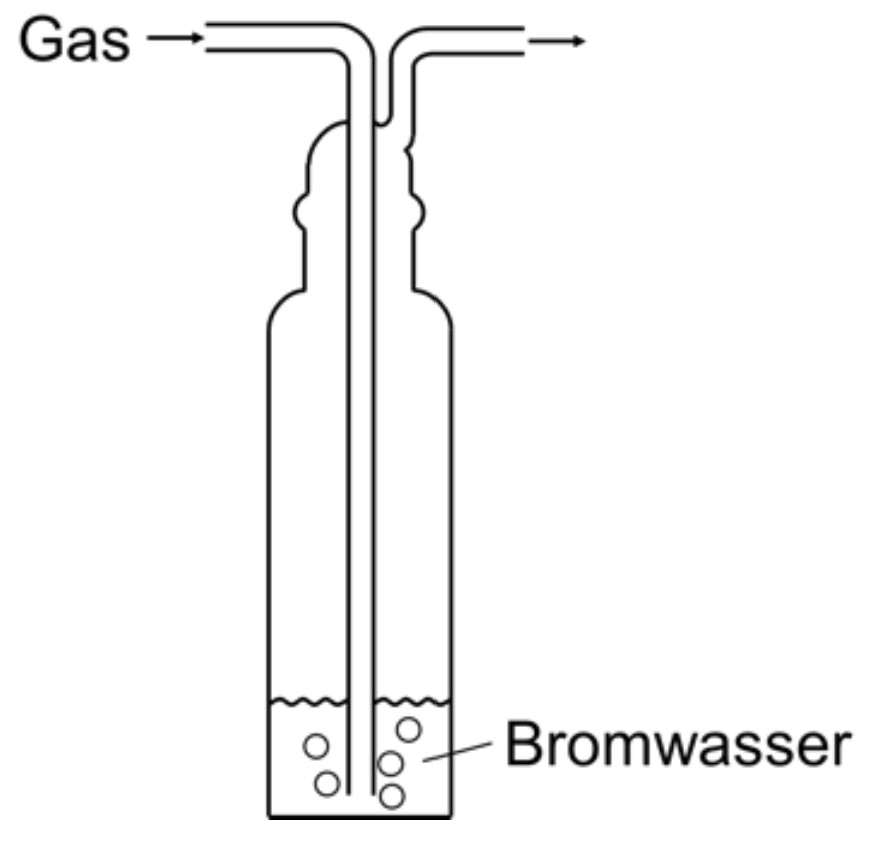
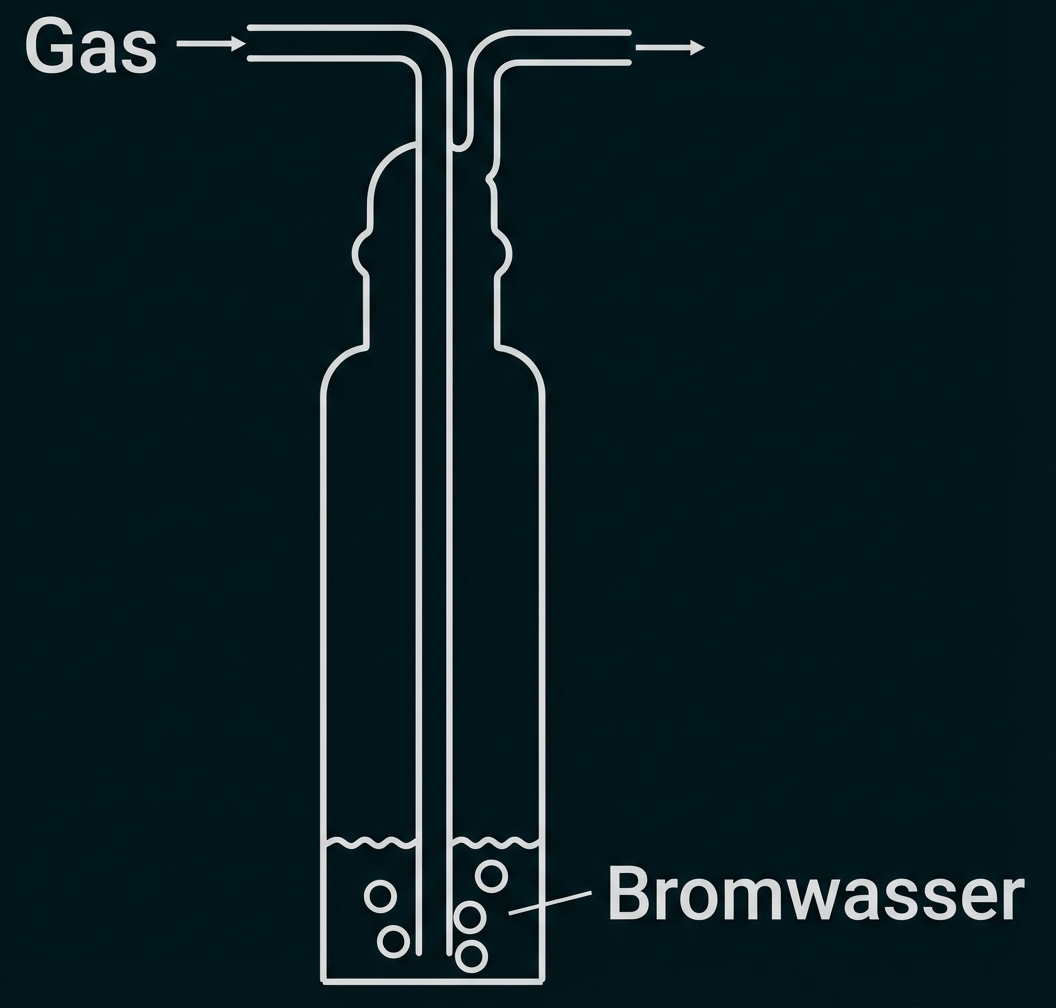
Beobachtung: Entfärbung des Bromwassers bei Einleiten von Isopren, keine Entfärbung bei Methan.
Begründung der Entstehung des Nebenprodukts anhand des Reaktionsmechanismus der elektrophilen Addition an einer C=C-Doppelbindung unter Bildung des Nebenprodukts.
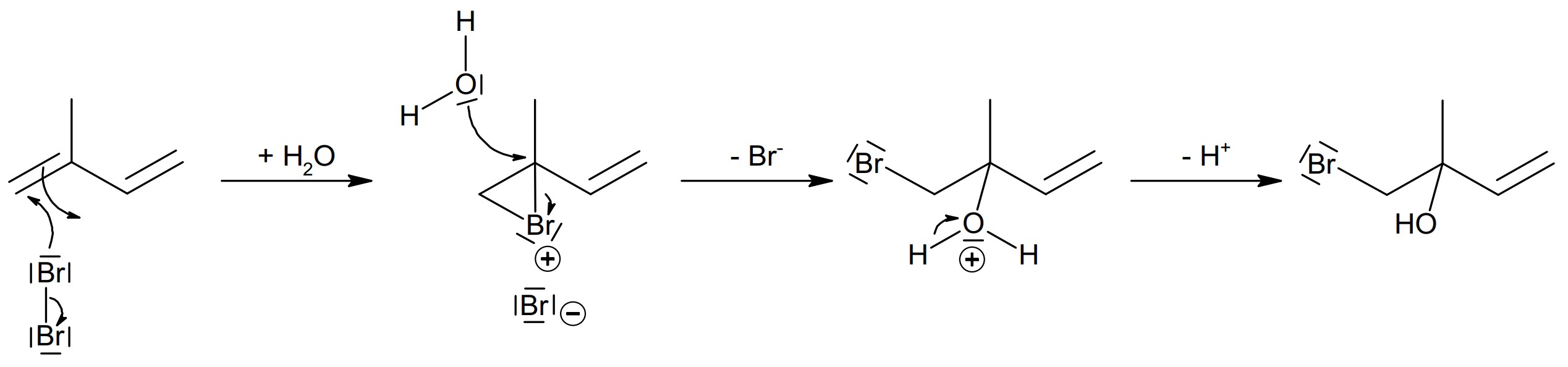
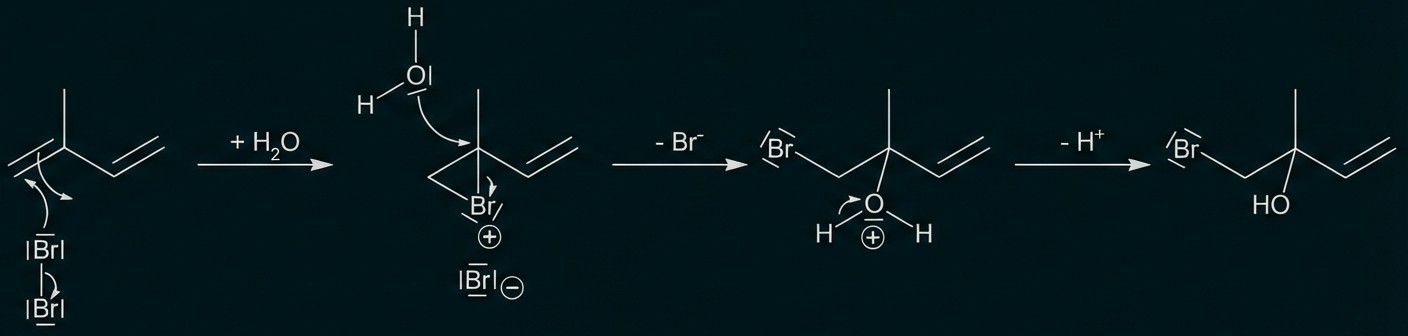
Reaktionsgleichung für Methan:
Reaktionsgleichung für Propan:
Anwendung des Satzes von Hess
Berechnung der Werte:
Die molare Masse von Methan ist kleiner als die von Propan. Demnach ist bei gleicher Masse die Stoffmenge von Methan größer als die von Propan, womit der Brennwert pro Masse bei Methan größer ist.
Abbildung 3: Von 1950 bis ca. 1974 Anstieg der Emissionen von Trichlorfluormethan; von ca. 1977 bis 1980 Absinken der Emissionen; von ca. 1980 bis 1988: Anstieg der Emissionen von Trichlorfluormethan, da es weltweit ohne Verbot genutzt wurde.
Von ca. 1988 bis 2007 kontinuierliches Absinken der Emissionen, da immer mehr Länder dem Montreal-Protokoll nachkamen und Herstellung und Nutzung des Stoffes verboten, z. B. Bundesrepublik Deutschland seit 1991.
Von ca. 2007 bis 2018 stiegen die Emission wieder an entgegen des Kurvenverlaufs nach dem Montreal-Protokoll und trotz internationalem Verbot.
Interpretation z. B.: Illegale Produktion und Nutzung von Trichlorfluormethan.
Abbildung 4: Die Dicke der Ozonschicht nimmt mit Schwankungen von ca. 1956 bis 1994 ab, nimmt dann leicht zu und geht etwa ab dem Jahr 2000 nicht mehr unter einen Mindestwert mit zwischenzeitlich deutlichen Zunahmen.
Zusammenhang der Aussagen von Abb. 3 und 4: Je größer die Emissionen von Trichlorfluormethan sind, desto stärker ist mit zeitlicher Verzögerung eine Abnahme der Dicke der Ozonschicht zu erkennen.
Reaktionsgleichungen:
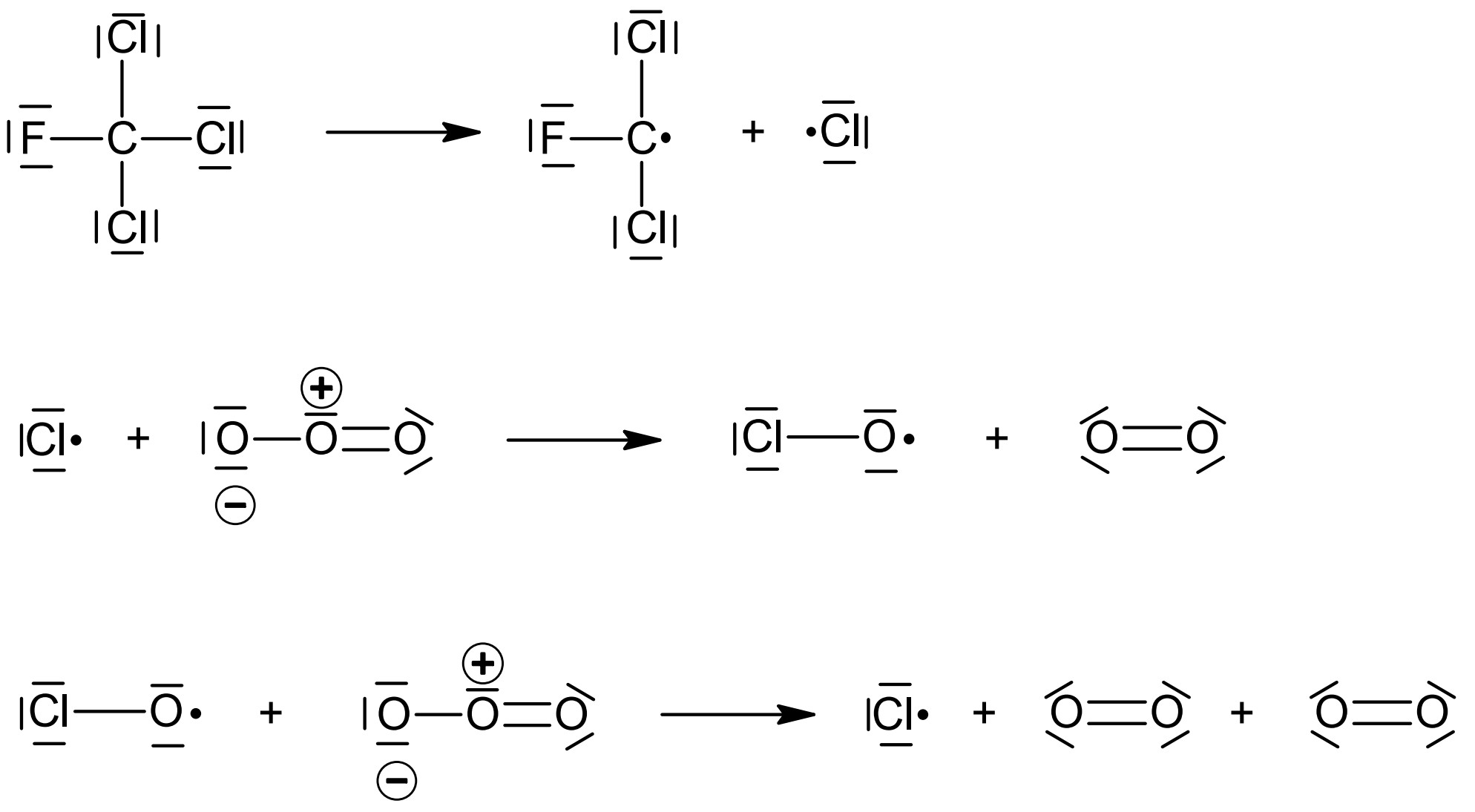
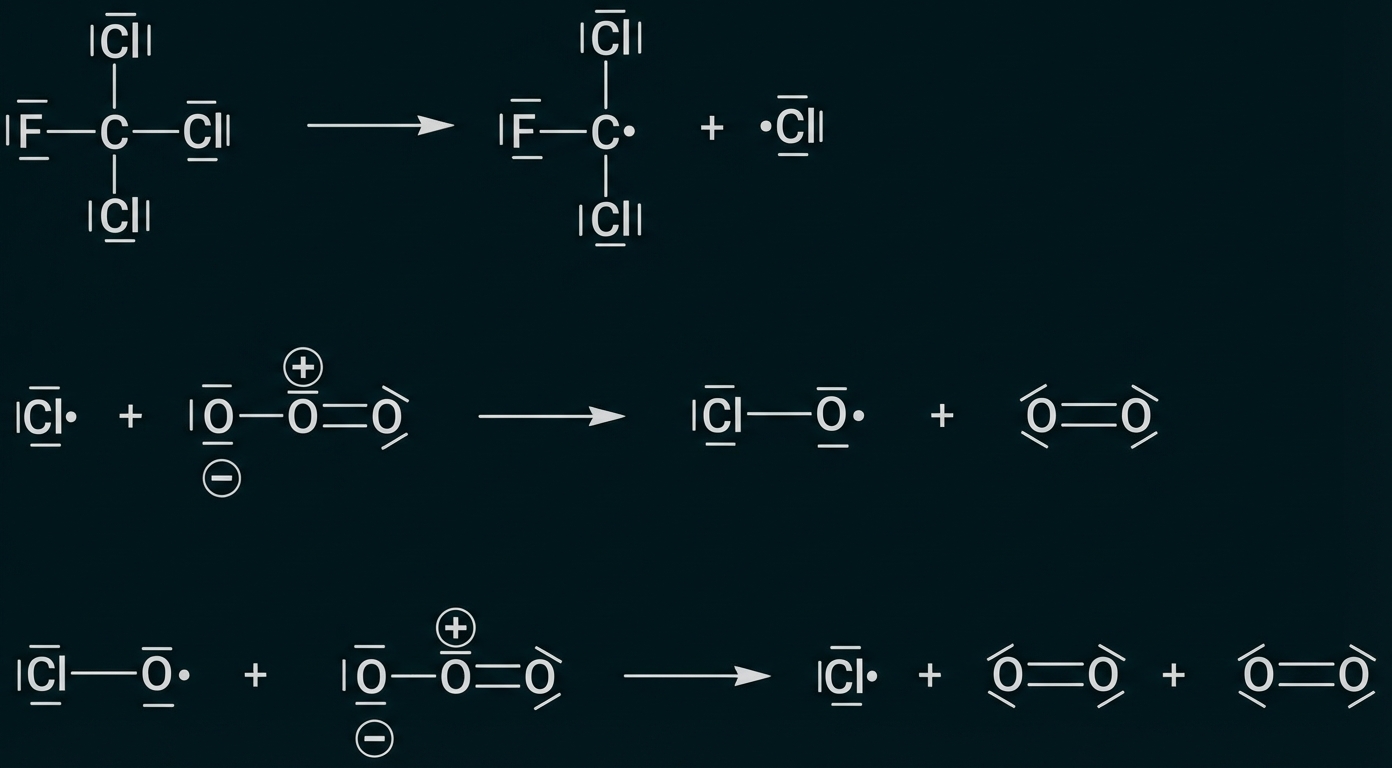
Vorteil Modellvorstellung: z. B. höhere Anschaulichkeit (räumlicher Bau)
Vorteil Reaktionsgleichungen mit Valenzstrichformeln: z. B. Darstellung der ungepaarten Elektronen
Die Modellvorstellung wird gestützt, da Trichlorfluormethan durch Bildung von Chlor-Radikalen zu einem katalytischen Abbau von Ozon zu Sauerstoff führt.
Beurteilung zur Eignung der Edukte für die Herstellung von 4-Chlortoluol:
Chlor ist geeignet, da nur Chlor-Atome für die elektrophile Substitution vorhanden sind. Wasserstoffchlorid ist ungeeignet, weil das Chlor-Atom negativ polarisiert ist und deswegen nicht als Elektrophil angreifen kann.
Ableitung der Reaktionsbedingungen mit Benennung der Reaktionsmechanismen:
Benzylchlorid bildet sich über eine radikalische Substitution an der Methylgruppe. Zur Bildung von Chlor-Radikalen ist entweder Belichtung oder Erhitzen nötig.
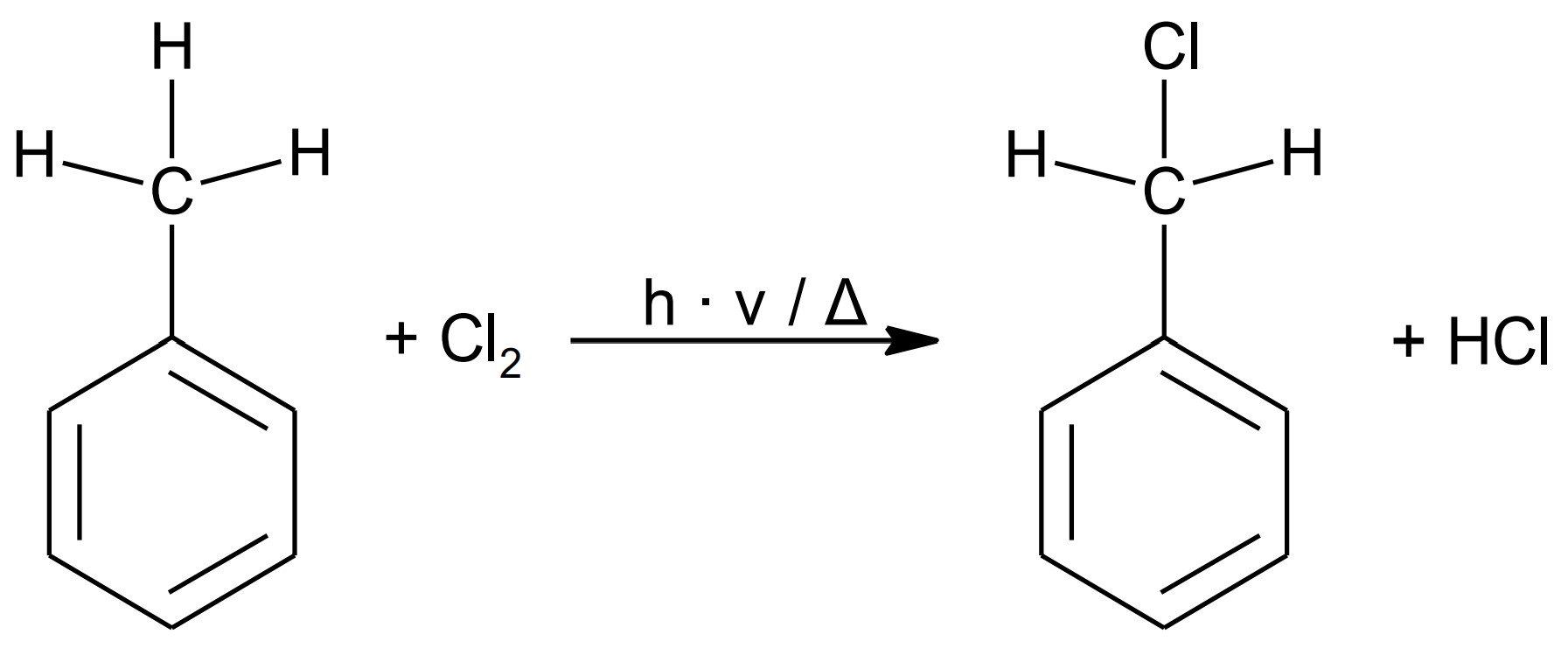
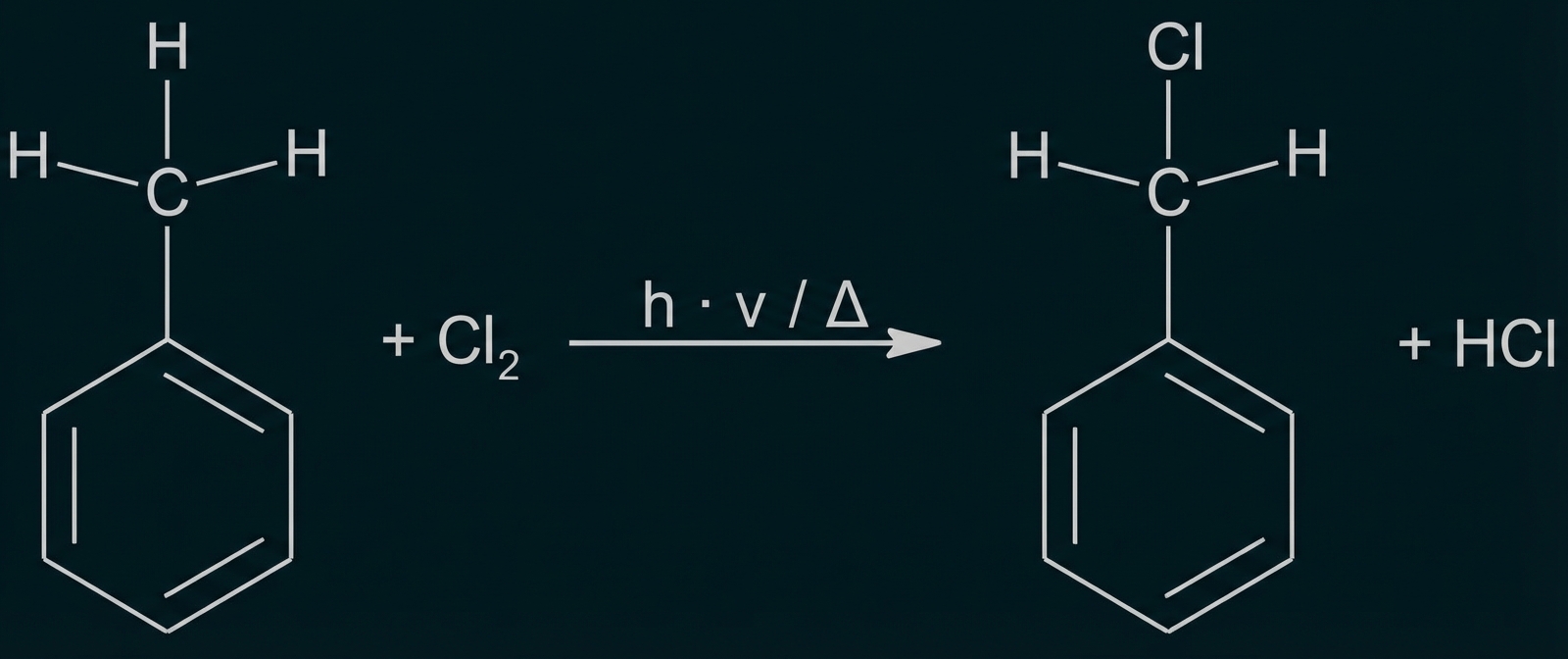
Zur Bildung von 4-Chlortoluol durch elektrophile Substitution am aromatischen Ring darf nicht erhitzt werden, es ist aber ein Katalysator, z. B. Eisen(III)-chlorid notwendig.